摘要
背景
3-羥基-3-甲基戊二醛輔酶A (HMG-CoA)裂解酶缺乏是一種罕見的先天性代謝錯誤,其特征是由禁食、並發疾病和過度體育鍛煉引起的周期性代謝危機。非酮症低血糖通常是主要症狀的原因,但如果不立即治療,該疾病可能演變成類似Reye綜合征的代謝狀態惡化,可能導致患者死亡。我們報告一個病例的一些臨床和治療特點,以前沒有描述。
案例展示
2歲確診為HMG-CoA裂解酶缺乏的患者,在飲酒後嚴重代謝失代償後,12年後再次入院。盡管低血糖很快得到了糾正,但在接下來的幾個小時內,病人陷入了昏迷。懷疑顱內高壓(ICH),患者需要機械通氣。雖然肝細胞溶解很少,但在給予苯乙酸鈉和苯甲酸鈉幾小時後,高氨血症達到1394 μmol/L,恢複正常,這些患者中未見使用苯乙酸鈉和苯甲酸鈉的報道。腦水腫在計算機斷層掃描和磁共振成像中得到證實,通過表觀擴散係數圖中擴散限製的量化,確定水腫是細胞毒性的。在腦出血恢複過程中,我們發現了中重度的血管痙攣,並用尼莫地平治療。目前患者臨床情況正常。
結論
HMG-CoA裂解酶缺乏症患者必須避免飲酒。我們的病人用苯乙酸鈉和苯甲酸鈉有效地治療了高氨血症。核磁共振成像顯示並量化了細胞毒性腦水腫。後來發現,腦血管痙攣是腦損傷的附加機製。這些觀察結果之前都沒有報道過。
背景
3-羥基-3-甲基戊二醛輔酶A (HMG-CoA)裂解酶缺乏症是一種隱性常染色體遺傳病,由Faull等人首次描述。[1].這種線粒體酶催化HMG-CoA的裂解形成乙酰輔酶a和乙酰乙酸,這是酮生成和亮氨酸降解的常見最後一步[2].該疾病的特征是反複發生的代謝危機,通常開始於新生兒早期(30%)或生命的第一年(60%)[3.].這些危機是由禁食、並發疾病和過度體育鍛煉引起的[2].
非酮症低血糖通常是主要症狀的原因。但這種疾病可能會演變成一種類似雷氏綜合征的代謝狀態惡化[3.].這種危機可導致20%的病例死亡,並造成嚴重的長期健康困境,如精神運動障礙、癲癇、肝脂肪變性、胰腺炎或擴張型心肌病[2].
HMG-CoA裂解酶缺乏症患者具有診斷性尿有機酸模式[1,4].確診需要確定酶活性或基因研究。被改變的基因是HMGCL,位於染色體1p36.1上,目前已鑒定出48個突變[5,6].在地中海國家最常見,世界上第二常見的是E37X [7,8].
我們報告一例HMG-CoA裂解酶缺乏的新病例,在2歲確診後,在飲酒後嚴重的代謝失代償後,12年後再次入院。
案例展示
由於感冒,在12小時的食物排斥和嘔吐後,我們的2歲西班牙兒童被送入兒科重症監護病房(PICU),臨床症狀為活動乏力、張力減退、嘔吐和短暫的意識喪失。該患者既往無相關疾病。患者父母為摩洛哥人,有血緣關係,無任何明顯疾病。
入院時患者檢查顯示格拉斯哥昏迷評分(GCS) 13-14分,疲倦,張力減退,輕度肝腫大。生命體征都很正常。血液分析顯示嚴重低血糖(29 mg/dL),無酮症,中度代謝性酸中毒和高乳酸血症(10.3 mmol/L)。銨含量略升高(86.7 μmol/L);靜脈注射葡萄糖後,血糖立即和持續穩定。接下來的12小時,代謝性酸中毒、高乳酸血症和意識恢複正常。腦電圖(EEG)顯示無明顯病理改變,磁共振成像(MRI)顯示FLAIR和T輕度高信號2額葉皮層下白質序列提示脫髓鞘區。代謝研究顯示尿中亮氨酸代謝物增加,懷疑是HMG-CoA裂解酶缺乏。診斷確認是通過遺傳研究完成的:患者是E37X純合子突變。患者接受左卡尼汀治療和門診控製,直到3歲時,他縮短了就診時間。
14歲時,他因幾小時前飲酒(3杯伏特加加可樂)後嘔吐而失去意識,回到我們兒科急診科。這家人沒有提及以前的疾病或入院情況,除了一些嬰兒已經解決的低血糖發作。經檢查,患者已失去知覺,伴有眼球驚動、全身震顫和高張力,提示廣泛性強直性癲癇發作。其他生命體征均正常。血液分析顯示嚴重低血糖(8 mg/dL),無酮症、代謝性酸中毒(pH值7.28,pC0)232.4 mmHg, HC03.−14.9 mEq/L,堿基過剩- 10.4 mEq/L)和高乳酸血症(5.6 mmol/L)。血液生化演變見表1.通過靜脈輸注葡萄糖對低血糖進行快速糾正,這導致患者意識的初步恢複(GCS 13-14)。
盡管保持正常血糖水平,但接下來的4小時見證了進一步的神經惡化,在躁動和漸進式嗜睡之間交替。懷疑顱內高壓(ICH),患者被送入PICU。治療開始采用抗水腫措施(甘露醇、速尿和體位治療),並靜脈給予左卡尼汀(100 mg/kg)。第一次測定銨量後,通過鼻胃管給藥。緊急進行頭顱計算機斷層掃描(CT),發現白質慢性缺陷,但沒有腦水腫的跡象。PICU入院後8小時,GCS持續惡化至< 9。患者需要有創機械通氣。為了治療高氨血症,給予苯乙酸鈉和苯甲酸鈉靜脈注射,雖然準備了持續的靜脈血液透析濾過,但由於高氨血症迅速下降,直到幾小時內完全恢複正常才使用1).
使用雙譜指數監測(BIS),腦電活動記錄值在25-40之間。24小時腦電圖顯示腦生物電活動嚴重和全局性減慢,經顱多普勒(TCD)顯示搏動指數彌漫性輕微-中度增加(1.1-1.3),與輕度腦出血相符,CT掃描顯示皮層-皮層下分化彌漫性惡化,腦室和蛛網膜下腔縮小。都與腦水腫相符。
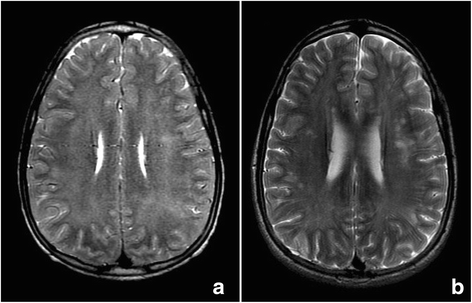
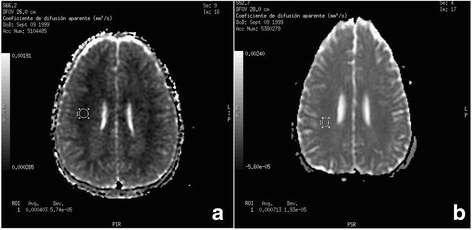
在48小時,腦電圖檢測到慢波的存在,但有顯著的生物電改善,通過鎮靜撤消。TCD顯示在左半球占優勢的所有區域平均速度(180-190 cm/s)增加,與中等-嚴重的血管痙攣一致。因此,治療開始靜脈注射尼莫地平。在隨後的12小時內,患者BIS值一直<50,隨後在PICU入院72小時後蘇醒並拔管(GCS 13-14)。隨後的MRI顯示FLAIR和T呈高強度白質信號2序列,與基礎代謝性白質腦病(圖。1),但也顯示了新的來源,在擴散加權成像中,顯示細胞毒性水腫的表觀擴散係數(ADC)降低(圖1)。2).
在8號th日間神經係統檢查與腦電圖及TCD檢查正常,停用尼莫地平治療。再次,當患者出院時,我們建議繼續使用左旋肉堿治療。8個月時的MRI顯示ADC正常,但存在T區信號增加的特定區域2FLAIR序列表明腦室周圍腦實質和以前脫髓鞘的區域有明確的殘餘損傷(圖。1 b而且2 b).目前患者臨床情況正常。
討論
在HMG-CoA裂解酶缺乏症患者中,產生空腹低血糖的主要機製是外周組織使用過多的葡萄糖,因為由於二次肉堿的缺乏,外周組織不能有酮或遊離脂肪酸進行氧化。這種缺陷是由於酰基輔酶a過量造成的,酰基輔酶a在酯化成酰基肉堿後在尿液中丟失[2,4,6].基於這些原因,這些患者應堅持在飲食中補充左旋肉堿(75-100 mg/kg/天)[9].我們的患者在14歲時沒有遵循這一建議,可能是因為患者幾年來一直無症狀,家人對這種疾病的慢性性質失去了意識。這種缺陷可能促進了Reye綜合征的發展,正如在脂肪酸氧化的其他酶缺陷中所描述的那樣。此外,在這一階段,酒精的攝入可通過阻斷丙酮酸生成新糖而加劇代謝危機。
如前所述,這種疾病可能演變為Reye綜合征,據報道會引起嚴重的細胞溶解。然而,在我們的患者中,轉氨酶隻發生了最低限度的升高。因此,沒有肝細胞溶解並不排除存在嚴重的肝性腦病。由於這些原因,在任何失代償中都必須測定血銨水平。在我們的病人靜脈注射苯甲酸酯和苯乙酸鈉是一個非常有效的治療高氨血症。有人認為這種治療方法可能對這些患者有用[10但此前從未報道過。Quick指數和Factor VII的變化提示肝髒綜合功能也受到影響。d -二聚體的正常值支持這一假設。最小的細胞溶解也可以解釋PICU患者在排毒和支持治療後肝功能迅速恢複和康複。
典型的特點是,對這些患者進行的神經影像學研究顯示CT掃描顯示彌漫性腦白質低密度,T表現為腦白質高密度2加權MRI研究[3.,5].然而,關於急性發作期間神經影像學檢查結果的信息較少。在MRI上,我們在ADC圖上發現腦水腫為細胞毒性型,擴散受限。其中,腫脹細胞在細胞外空間產生減少分子擴散減少,這是量化的,在我們的患者中,在最初的研究中減少,在8個月後進行的測試中恢複正常。這一發現此前沒有被描述過。
這些患者的腦梗死與生化機製有關,與血供喪失無關[11].然而,除了腦出血外,在我們的患者中,48小時的TCD檢測到另一種以前未描述的腦損傷血管機製。因此,在腦出血改善後,血管痙攣可能遲發性加重了腦缺血損傷。也許這一機製可以解釋Huemer等人描述的代謝失代償後4天出現血管分布的缺血性腦梗死[12].盡管患者的臨床症狀明顯完全恢複,但值得注意的是,8個月後進行的MRI檢查發現左側優勢腦實質室周區殘留損傷,TCD檢測到的血管痙攣更嚴重。因此,我們認為必須對這些患者進行TCD監測。
據幾位作者報道,隨著年齡的增長,人們對禁食的耐受性會增強。2,10].然而,我們想指出的是,這種遺傳疾病是無法治愈的。因此,在我們的患者中,最嚴重的代謝危機發生在診斷12年後,當時家人已經失去了對疾病的自覺意識。由於這些原因,必須使家屬了解這種疾病的慢性性質。
結論
HMG-CoA裂解酶缺乏症患者必須避免飲酒,因為它可以加速和加劇雷氏樣綜合征的發作。沒有肝細胞溶解並不排除存在嚴重的肝性腦病。我們的病人用苯乙酸鈉和苯甲酸鈉有效地治療了高氨血症。急性期MRI顯示並量化了細胞毒性腦水腫。後來發現,腦血管痙攣是腦損傷的附加機製。最後,這類患者必須避免禁食並保持左卡尼汀的補充。
縮寫
- ADC:
-
表觀擴散係數
- 國際清算銀行:
-
雙頻譜指數
- CT:
-
計算機斷層掃描
- 腦電圖:
-
腦電圖
- 天賦:
-
流體衰減反演恢複
- gc:
-
格拉斯哥昏迷量表
- β-:
-
3-Hydroxy-3-methylglutaryl-coenzyme一
- 我:
-
顱內高血壓
- 核磁共振成像:
-
磁共振成像
- PICU:
-
兒科加護病房
- 浴室:
-
經顱多普勒
參考文獻
Faull K, Bolton P, Halpern B,等。亮氨酸分解代謝缺陷患者。中華醫學雜誌1976;294:1013-5。
Santarelli F, Cassanello M, Enea A,等。新生兒3-羥基-3-甲基戊二酸輔酶A裂解酶缺乏症1例。兒科雜誌2013;39:33。
Zafeiriou DI, Vargiami E, Mayapetek E, augoustiou - savvopoulou P, Mitchell GA。3-羥基-3-甲基戊二酰輔酶A裂解酶缺乏症,治療後白質改變可逆。兒科神經科學。2007;37:47-50。
Dos Santos MM, Ribas GS, Wayhs CA,等。3-羥基-3-甲基戊二酸尿患者氧化應激增加。中國生物醫學工程學報。2015;29(1-2):447 - 447。
Reimao S, Morgado C, Almeida IT, Silva M, Real HC, Campos J. 3-羥基-3-甲基戊二醛輔酶A裂解酶缺乏症:初見於年輕人。J Inherit Metab Dis. 2009;32增補1:S49-52。
Leipnitz G, Regla Vargas C, Wajener M.氧化還原穩態紊亂是3-羥基-3-甲基戊二醛輔酶a裂解酶缺乏症腦和肝髒改變的潛在病理機製。J Inherit Metab Dis 2015; 38:1021-8。
Pié J, Casals N, Casale CH,等。3-羥基-3-甲基戊二醛-輔酶A裂解酶基因的無義突變在兩名不同來源的3-羥-3-甲基戊二醛-輔酶A裂解酶缺乏症患者中產生外顯子跳變。生物化學學報1997;32:329 - 35。
米爾·C, Lopez-Viñas E,阿萊多·R,等。在HMG-CoA裂解酶的3D結構模型中,單殘基突變G203E通過阻斷底物通道導致3-羥基-3-甲基戊二酸尿。中華醫學雜誌2006;29:64-70。
Pierron S, Giudicelli H, Moreigne M,等。Déficit zh 3-HMG-CoA裂解酶à révélation遲發:savoir rerre une maladie罕見的mais traitable。Arch兒2010;17:10-3。
Gibson KM, Breuer J, Nyhan WL。3-羥基-3-甲基戊二醛輔酶A裂解酶缺乏症:18例報告患者的回顧。中華兒科雜誌1988;148:180-6。
3-羥基-3-甲基戊二酰輔酶A裂解酶缺乏症患者的腦梗死和胰腺炎可能的並發症。J Inherit Metab Dis. 2000; 23:636-7。
Huemer M, Muehl A, Wandl-Vergesslich K, Strobl W, Wanders RJ, Stoeckler-Ipsiroglu s 3-羥基-3-甲基戊二酰輔酶A裂解酶缺乏的嬰兒中風樣腦病。中華兒科雜誌1998;157:743-6。
確認
感謝PICU的所有工作人員,他們全心全意地照顧孩子和他們的家庭。半徑標注。阿德拉·梅瑟格爾和德拉。感謝羅薩裏奧·吉爾一直以來的支持。感謝詹姆斯·彼得斯在語言翻譯方麵的幫助。
資金
作者沒有此項研究的資金。
數據和材料的可用性
這裏所介紹的所有數據都收集在病人的醫療記錄中,可以與適當的授權機構協商。
作者的貢獻
兒科醫生,負責PICU的患者護理,臨床病例分析,文獻綜述和文章起草。MCOS臨床病例分析,文獻回顧並撰寫文章。JLL評價RM圖片,修改文章的智力內容。所有作者閱讀並批準了最終稿件。
相互競爭的利益
作者聲明他們沒有競爭利益。
發表同意書
獲得家長的知情同意。
倫理批準和同意參與
醫院倫理委員會Clínico瓦倫西亞大學(西班牙)批準發表該病例報告。
作者信息
作者和隸屬關係
相應的作者
權利與權限
開放獲取本文根據創作共用署名4.0國際許可協議發布(http://creativecommons.org/licenses/by/4.0/),該協議允許在任何媒體上不受限製地使用、分發和複製,前提是您適當地注明原作者和來源,提供創作共用許可的鏈接,並說明是否有更改。創作共用公共領域奉獻放棄書(http://creativecommons.org/publicdomain/zero/1.0/)除另有說明外,適用於本條提供的資料。
關於本文
引用本文
Muñoz-Bonet, J, Ortega-Sánchez, M. & León吉雅羅,J. 3-羥基-3-甲基戊二醛輔酶a裂解酶缺乏症患者的治療和長期進展。Ital J兒科43, 12(2017)。https://doi.org/10.1186/s13052-017-0333-4
收到了:
接受:
發表:
DOI:https://doi.org/10.1186/s13052-017-0333-4
關鍵字
- HMG-CoA裂解酶缺乏
- Reye-like綜合症
- 酒精消費
- Hyperamoniemia
- 苯乙酸鈉和苯甲酸鈉
- 細胞毒性腦水腫
- 大腦血管痙攣