摘要
簡介
常染色體隱性多囊腎病(ARPKD;MIM#263200)是兒科最常見的腎囊性疾病之一,發病率為1:20 000。它是由基因突變引起的PKHD1基因,在6p12染色體上。臨床症狀是高度可變的,從晚發的輕度形式到嚴重的圍產期表現。嚴重肺功能不全新生兒的管理具有挑戰性,早期死亡的原因是敗血症或呼吸衰竭。在大量腎髒腫大的情況下,早期雙側腎切除術和腹膜透析可降低嬰兒死亡率。然而,關於手術的作用還沒有結論性的數據,決策取決於患者的臨床情況和中心的專業知識。
病人報告
我們在此描述一早產女嬰,圍產期,快速和雙側,雙腎生長異常,呼吸衰竭和最初的肝病跡象。她隨後被證實感染了一種罕見和嚴重的純合突變PKHD1吉恩,遺傳自她的近親父母。我們的患者在出生後78天死亡,由於真菌敗血症惡化了她的呼吸功能不全。
結論
本病例報告顯示了新生兒ARPKD的一些臨床和倫理問題,以及多學科方法和與家庭良好溝通的需要。靶下一代測序(NGS)技術可以指導和支持臨床醫生,並保證這些患者得到最適當的臨床管理,避免不必要和/或不成比例的治療。
簡介
常染色體隱性多囊腎病(ARPKD;MIM#263200)是兒科最常見的腎囊性疾病之一,發病率為1:20 000 [1].它是由基因突變引起的PKHD1第6p12號染色體上的基因(多囊腎和肝髒疾病-1,也稱為含有纖維囊蛋白/多ductin的纖毛IPT結構域)。其臨床表現是高度多變的,從晚發的輕度形式,到嚴重的圍產期表現(更多的是與截斷有關PKHD1變化)2].嚴重肺功能不全新生兒的管理尤其具有挑戰性,這也是由於缺乏可靠的臨床預後標誌物[3.,4].早期死亡的原因是敗血症或呼吸衰竭,這是由於肺發育不全和雙側腎水腫導致膈肌移位[2].在大量腎腫大的病例中,早期雙側腎切除術、支持性腹膜透析和早期積極營養可降低嬰兒死亡率[3.].然而,對於手術的作用和最佳時機並沒有結論性的數據,決策取決於患者的臨床情況和中心的專業知識[3.].我們在此描述一個圍生期,雙側快速,雙腎生長異常,呼吸衰竭和肝髒疾病的初始體征的女性早產新生兒。她隨後被證實受到一種罕見的,嚴重截斷的純合突變的影響PKHD1吉恩,遺傳自她的近親父母。
病人報告
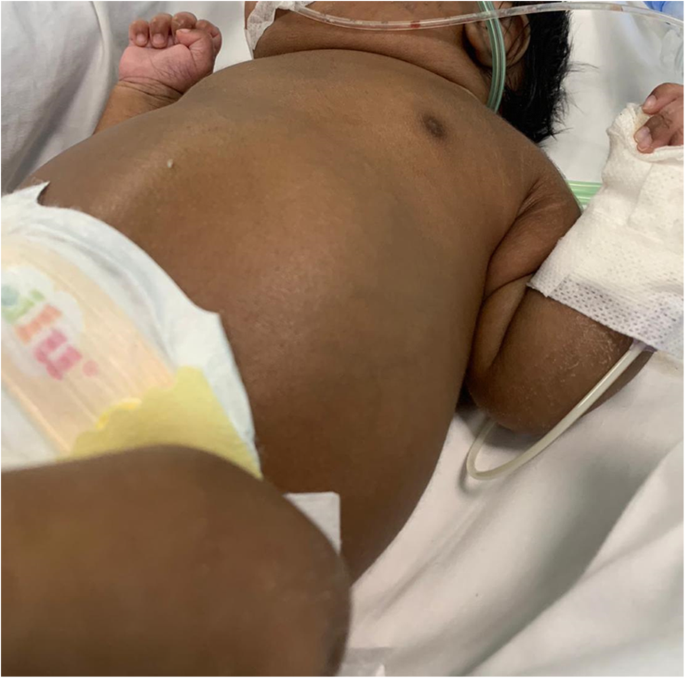
一名女嬰在33歲時出生+ 4妊娠數周,因早產和羊水過少而行剖宮產。她的父母是來自孟加拉國的一年級堂兄妹。他們和兩歲的妹妹都顯示出正常的腎髒和肝髒超聲檢查(US)和功能測試。家族史無異常,妊娠期明顯為孕前糖尿病,需要胰島素治療。產前觀察到羊水過少,但腎髒無任何腫大和/或回聲增強。出生時,人體測量數據如下:體重2170克(第98百分位),長度46厘米(第84百分位),枕額周長31厘米(第58百分位)。1 min和5 min時Apgar評分分別為8和9。體格檢查顯示典型的波特序列麵部(扁平的鼻子,小頜,大而低的耳朵),嚴重的腹脹,雙側可觸到腎大畸形(圖。1).頸部多餘皮膚,軸向張力不足和肢體攣縮也被觀察到。
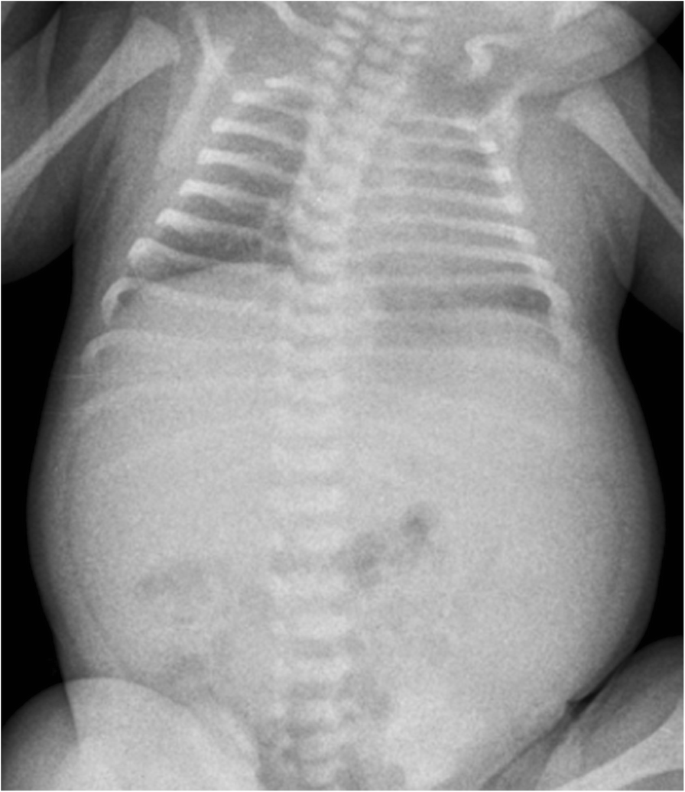
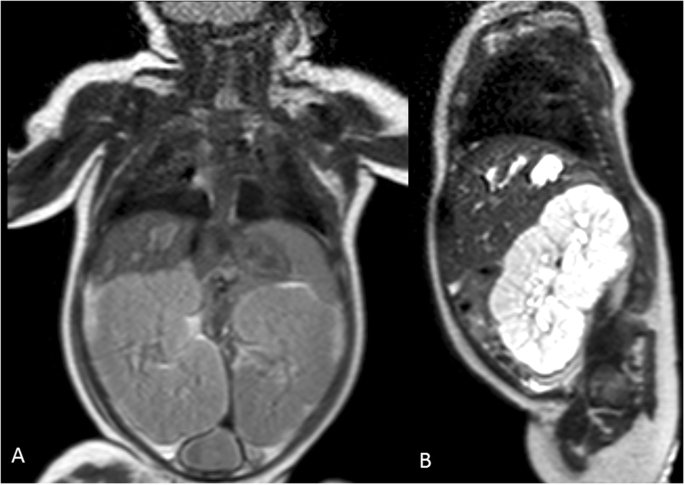
產後因肺發育不全出現嚴重呼吸窘迫綜合征,需要插管、表麵活性劑給藥和有創機械通氣(MV,吸氣峰值壓高達26cmh)2O) 10天。胸部x光片證實典型的肺發育不良。2).第1天腹部超聲示雙側囊性腎大瘤,右腎長5.5 cm,左腎長6.2 cm。腎功能中度受損,腎小球濾過率(Schwartz公式計算)為10.12 mL/min/1.73m2(k = 0.33)。出生後數小時出現少尿(尿量低於1毫升/公斤/小時),出生後不久,需要逐步增加利尿劑和多巴胺的劑量。此外,新生兒尿鈉排泄量增加,鉀排泄量減少,隨後出現低鈉血症和高鉀血症,經氯化鈉和液體限製方案糾正。超聲檢查發現雙腎快速進行性增大(最大縱向直徑約8.5 cm),直到出生第三周。腎形態表現為雙側皮質-髓質分化差,典型的胡椒-鹽型(實質回聲彌漫性增高,伴有小髓質囊腫和集管梭狀擴張)[5].此時,出生20天左右,患者出現嚴重高血壓,最大收縮壓137 mmHg,平均動脈壓129 mmHg(> 95厘壓)。然而,逐漸增加靜脈注射氨氯地平和速尿劑量(最大劑量分別為0.4 mg/kg/天和4 mg/kg/天)的降壓治療並不能有效控製血壓。2月齡腹部磁共振示雙腎腫大(右8.5 × 5.4 cm,左8.2 × 5.4 cm),結構改變,腎緣隆起,腎功能下降(造影劑浸潤髓質輕度不均一,無明顯皮質和排泄相),腎放射性核素顯像進一步證實。肝髒增大,右葉外周膽道擴張,VII和VIII節段至少有兩個囊性病變(圖。3.).
在整個住院期間,由於腹部腫塊壓迫,建立腸內喂養尤其具有挑戰性。然而,盡管隻維持了4天,還是插入了鼻空腸喂食管。然後,由於未能確保有效的管飼方案,開始了全腸外營養(TPN)。
新生兒在出生第70天之前不需要任何呼吸機支持,但由於低蛋白血症和嚴重的甲狀腺功能減退,導致腎髒腫大、貧血和水腫加重,因此再次需要使用MV。此時超聲心動圖顯示左心室和室間隔肥厚,動脈冠狀動脈擴張和肺動脈高壓(平均血壓35 mmHg)。
由於患者仍然依賴MV和TPN,我們討論了繼續進行腎切除術的選擇。家長得到了充分的谘詢,了解了好處/風險比和預後,以及可用的選擇,如手術幹預、透析,包括與移植和潛在終身依賴有關的問題[6或姑息治療。然後,在考慮到父母的意願的情況下,在文化調解人的支持下,進行了包括生物倫理方麵在內的多專業和多學科討論。在谘詢結束時,家長同意積極管理。
然而,臨床狀況迅速惡化。事實上,我們的病人在出生第78天就去世了,死於真菌敗血症,這明顯惡化了她的呼吸功能不全。
同時通過靶NGS獲得ARPKD的基因組診斷,經Sanger測序證實。純合突變NM_138694.4:c。5323C > T (p.Arg1775Ter)的PKHD1先證者基因鑒定。這種變異,很少與ARPKD相關[7,8,9],由父母雙方遺傳,他們是同一突變的雜合子攜帶者。它會在編碼蛋白質(通常包含4074個氨基酸)的1775號氨基酸處導致過早的停止密碼子,從而導致嚴重的截斷。
討論和結論
1994年,ARPKD的致病基因,PKHD1,被映射到6p12染色體上。然而,直到最近幾年才對其進行測序,從而獲得了受影響患者的基因組概況,以及與其他腎囊性疾病的鑒別診斷[10,11,12,13].
大多數ARPKD患者在妊娠晚期或出生時被發現。即使是孕中期胎兒超聲檢查也常常無法檢測到雙腎腫大和/或回聲增強[10,14羊水過少可能是該病的唯一症狀,正如本例患者所發生的一樣。圍生期診斷為腎腫大的新生兒預後較差,通常在出生後的頭幾天內死於呼吸問題[2,15,16].
本報告所述腎髒異常迅速增大,引起了有關疾病的致病機製的問題。具體來說,我們的先驗證子罕見的純合突變表現得特別嚴重,因為它是一個無義變體,在編碼蛋白的氨基酸序列中插入了一個停止密碼子(聚ductin/纖維囊蛋白,4074個氨基酸)。事實上,PKHD1轉錄本在1775氨基酸處中斷,缺少其主要部分。這提示該蛋白存在嚴重的功能損害,並可能解釋其臨床嚴重程度和不良結果proposita.然而,我們新生兒的嚴重臨床演變也可能與其他因素有關PKHD1基因型(以已報告的受影響兄弟姐妹的家庭內臨床變異性為依據)[2].它也可能取決於其他遺傳和/或表觀遺傳因素[17].因此,疾病的嚴重程度既可歸因於修飾基因,也可歸因於環境因素。在我們的患者中,與母體糖尿病相關的糖代謝紊亂可能在受孕前,改變母體生發細胞的生物學/分子特征,以及在胚胎-胎兒發育過程中產生有害影響[2,18,19].
從生物化學/分子的角度來看,人們認為蛋白質,如表皮生長因子受體(EGFR),在這類患者的囊性腎上皮細胞中異常表達。它們的表達增加與上皮增生有關,導致囊腫進行性增大[2].此外,在這些受試者中觀察到mTOR(雷帕黴素激酶機製靶點)信號通路的激活增加[20.].這兩種機製,與其他疾病一樣,可能解釋了囊性上皮細胞的高度增殖,這導致了我們的患者以及那些具有重疊臨床特征的患者的嚴重表型。此外,在一些ARPKD患者中報告了肺動脈高壓[2和存在於我們的新生兒中,可能識別這種生化/分子改變。因此,除了慢性缺氧外,它可能與內皮功能障礙和血管平滑肌細胞的過度收縮有關[2].
盡管最近在新生兒護理、遺傳知識和兒童腎移植預後方麵取得了進展,但迄今為止,1年死亡率仍在30%左右[21],且通常與肺發育不良有關,而不是腎功能不全[3.].MV是長期生存的一個強有力的負麵預測因子,需要呼吸機支持的患者,如我們的新生兒,其死亡率高於那些出現高血壓、進行性腎功能不全和門脈纖維化的患者[10].
單側或雙側腎切除並隨後腹膜透析已被報道作為特定受試者的治療方法[2].
因此,對嚴重影響的新生兒的管理主要集中於MV,偶爾也會進行單側或雙側腎切除術[3.].事實上,早期切除兩個快速生長的腎髒,先發製人的腹膜透析,因為隻有在腹膜透析無法進行時才可能考慮血液透析[2]和腎移植,可能是呼吸障礙患者最有前途的選擇,由於圍/產後腎髒生長增加[10].然而,必須仔細權衡加速腎功能喪失的風險,以及因此需要在生命早期進行腎髒替代治療[3.,22].在我們的患者中,臨床條件的暴發性惡化不允許有效的治療計劃。事實上,目前的患者顯示了一些臨床和生物倫理問題,也與在ARPKD新生兒管理中可能出現的文化和語言差異所遇到的困難有關。
該患者報告可能為ARPKD的分子發病機製提供進一步的見解,以及更好的疾病基因組和臨床表征。對新患者的研究將有助於進一步概述基因型-表型的相關性[23].
未來的希望可能來自對潛在基因組/分子機製的更深入的了解,這可能導致有效的治療[24](即抑製mTOR以減弱囊性上皮細胞的生長,對其他病理也可能有用)[25,26].
與此同時,下一代測序(NGS)技術所發揮的作用正變得越來越寶貴和決定性。這些方法提供了精確的基因組信息,使得侵入性檢查(如ARPKD中的腎活檢)不再必要,並允許定義更準確的預後。事實上,如果及時獲得,它們可以指導和支持臨床醫生,並保證對患者進行最適當的臨床管理,避免無效和/或不成比例的治療,以及兒童和父母之間進一步不必要的分離[27].然後,在危急的情況下,就像我們的病人,注意力可能會從侵入性方法轉移到另一個目標上,那就是減少痛苦。
數據和材料的可用性
本研究中使用和分析的數據集可根據合理要求從通訊作者處獲得。
縮寫
- ARPKD:
-
常染色體隱性多囊腎病
- 表皮生長因子受體:
-
表皮生長因子受體
- MV:
-
機械通風
- mTOR:
-
雷帕黴素激酶的機製靶點
- 門店:
-
新一代測序
- PAPs:
-
肺動脈收縮壓
- PKHD1:
-
多囊腎和肝病
- TPN:
-
全靜脈營養
- 我們:
-
超聲
參考文獻
早期和嚴重的多囊腎病和相關纖毛蟲病:一個新興的興趣領域。腎元。2019;141(1):50 - 60。
Arbeiter A, Büscher R, Bonzel KE, Wingen AM, Vester U, Wohlschläger J, Zerres K, Nürnberger J, Bergmann C, Hoyer PF.常染色體隱性多囊腎病(ARPKD)患者腎快速腫大和EGFR表達增高的腎切除術。腎移植。2008;23(9):3026-9。
Mallett TM, O'Hagan E, McKeever KG。嬰兒常染色體隱性多囊腎病的早期雙側腎切除術。BMJ病例報告2015;2015:bcr2015211106。
阿比斯H, Maker GL, Trengove RD。腎髒疾病的代謝組學診斷和理解方法。代謝物。2019;9(2):34。
陳曉燕,李曉燕,陳曉燕,陳曉燕。纖毛病相關腎髒疾病分子診斷兒童腎超聲“鹽與胡椒”模式的研究。35 Pediatr Nephrol。2020;(6):1033 - 40。
Burgmaier K, Kunzmann K, Ariceta G,伯格曼C, Buescher AK, Burgmaier M, Dursun我Duzova,開齋節L F erg, Feldkoetter M, Galiano M,通用電氣ß尼珥M, Goebel H, Gokce我Haffner D, Hooman N,霍普B, Jankauskiene,克勞斯G,康尼錫J, Litwin M,馬薩拉L, Mekahli D,米勒E,米爾年代,佩普L, Prikhodina L, Ranchin B,席爾德R, Seeman T,切斷L,錢幣兌換商R,蘇NA, Stabouli年代,Stanczyk M, Tabel Y, Taranta-Janusz K,甲殼,Thumfart J, Topaloglu R,韋伯LT,濕草地D, Wuhl E, Wygoda年代,Yilmaz,Zachwieja K, Zagozdzon I, Zerres K, ESCAPE研究組。GPN研究小組;Dötsch J, Schaefer F, Liebau MC, ARegPKD財團。常染色體隱性多囊腎病患者早期透析依賴的危險因素199:22 J Pediatr。2018;28. - e6。
Melchionda S, Palladino T, Castellana S, Giordano M, Benetti E, De Bonis P, Zelante L, Bisceglia L.擴展130個具有ARPKD的先證者的突變譜:通過sanger測序和MLPA分析鑒定62個新的PKHD1突變中華免疫學雜誌。2016;61(9):811-21。
Obeidova L, Seeman T, Elisakova V, Reiterova J, Puchmajerova A, Stekrova J.捷克常染色體隱性遺傳性多囊腎病家係PKHD1的下一代分子遺傳測序分析。中華醫學雜誌2015;16:116。
Bergmann C, Senderek J, Windelen E, Küpper F, Middeldorf I, Schneider F, Dornia C, Rudnik-Schöneborn S, Konrad M, Schmitt CP, Seeman T, Neuhaus TJ, Vester U, Kirfel J, Büttner R, Zerres K. APN (Arbeitsgemeinschaft für Pädiatrische Nephrologie)。164例常染色體隱性多囊腎病(ARPKD)患者PKHD1突變的臨床結果腎髒Int。2005;67(3):829 - 48。
Prelog M, Bergmann C, Ausserlechner MJ, Fischer H, Margreiter R, Gassner I, Brunner A, Jungraithmayr TC, Zerres K, Sergi C, Zimmerhackl LB.移植成功治療與一種新型突變相關的快速進展常染色體隱性多囊腎病兒童。Pediatr移植。2006;10(3):362 - 6。
Bergmann C, Küpper F, Schmitt CP, Vester U, Neuhaus TJ, Senderek J, Zerres K. PKHD1基因多外顯子缺失導致常染色體隱性多囊腎病(ARPKD)。中華醫學雜誌2005;42(10):e63。
ARPKD和ADPKD的早期表現:原始多囊腎病和表型。Pediatr Nephrol。2015;30(1):15 - 30。
常染色體隱性多囊腎病的遺傳學及其鑒別診斷。Pediatr前麵。2018;5:221。
Erger F, Ortiz-Brüchle N, Gembruch U, Zerres K.常染色體隱性多囊腎病和其他遺傳性多囊腎病患者的產前超聲、基因型和結局中華婦產科雜誌2017;295(4):897-906。
羅芳,顧文智,陳錚,史麗萍,馬曉麗,林海傑,邱玉華。嬰兒多囊腎病1例報告及文獻複習。中華二客雜誌。2013年5月;51(5):377-81。
Khare A, Krishnappa V, Kumar D, Raina R.新生兒腎囊性疾病。中國婦嬰新生兒醫學雜誌2018;31(21):2923-9。
Corsello G, Salzano E, Vecchio D, Antona V, Grasso M, Malacarne M, Carella M, Palumbo P, Piro E, Giuffrè M.由於母親在14q32.2區域De novo 160kb缺失導致的父係單係染色體14樣綜合征,不包括IG-和MEG3-DMRs:患者報告和基因型-表型相關性。中華醫學雜誌2015;167A(12): 3130-8。
Serra G, Antona V, Schierz M, Vecchio D, Piro E, Corsello G.一例自然受孕不和諧新生兒食管閉鎖和Beckwith-Wiedemann綜合征:首次報道。臨床病例報告2018;6(2):399-401。
Serra G、Antona V、Corsello G、Zara F、Piro E、Falsaperla R. NF1微缺失綜合征:2例新發病例報告。《兒科雜誌》2019;45(1):138。
Fischer DM, Jacoby U, Pape L, Ward CJ, kuwertz - broering E, Renken C, Nizze H, Querfeld U, Rudolph B, Mueller-Wiefel DE, Bergmann C, Haffner d常染色體隱性多囊腎病(ARPKD)中AKT/mTOR通路的激活《腎髒移植》2009;24(6):1819-27。
Meliţ LE, mmargarinean CO, mmargarinean CD, mmargarinean MO, Aldea c新生兒多囊腎,一種潛在的危及生命的年齡條件:1例報告。醫學(巴爾的摩)。2019; 98 (44): e17707。
李誌剛,李誌剛,李誌剛,等。新生兒常染色體隱性多囊腎病早期雙側腎切除術:改善預後還是不必要的努力?Urologe a . 2017; 56(7): 882 - 6。
侯麗,杜燕,張敏,蘇萍,趙超,吳穎。囊性腎髒疾病兩個家族中發現PKHD1和AHI1的新突變。中華臨床雜誌2018;11(5):2869-74。
張愛民,王acm。瞄準常染色體顯性多囊腎病的新細胞疾病途徑。中華醫學雜誌。2018;33(8):1310-6。
Corsello G, Antona V, Serra G, Zara F, giambroone C, Lagalla L, Piccione M, Piro e 112例單中心神經纖維瘤病1型患者的臨床和分子特征。中華兒科雜誌2018;44(1):45。
Nowak KL, Edelstein CL。多囊腎病(PKD)中的細胞凋亡和自噬。細胞信號。2020;68:109518。
Obeidova L, Seeman T, Fencl F, Blahova K, Hojny J, Elisakova V, iterova J, Stekrova J.下一代靶向測序在兒童囊腎疾病中的結果往往改變臨床診斷。《公共科學圖書館•綜合》。2020;15 (6):e0235071。
確認
不適用。
資金
這項研究沒有獲得資助。
作者信息
作者和聯係
貢獻
GS收集和分析臨床資料,並起草手稿。GC進行了基因評估,修改了手稿,最終批準了提交的版本。VA對基因數據的解釋做出了貢獻。MDA進行腎髒學評估。NC有助於患者的臨床管理,並進行儀器調查。MC進行了手術評估。MG對患者的臨床管理和基因數據的解釋做出了貢獻。MS對患者的臨床管理和起草手稿做出了貢獻。EP進行了神經學評估,修改了手稿,最終批準了提交版本。
相應的作者
道德聲明
倫理批準和同意參與
新生兒入院時獲得父母雙方的書麵知情同意。該研究得到了巴勒莫大學(Palermo, Italy)母嬰係的批準。本報告中執行的所有程序都符合機構和國家研究委員會的道德標準,以及1964年《赫爾辛基宣言》及其後來的修正案,或類似的道德標準。
同意出版
不適用。
相互競爭的利益
作者聲明他們沒有競爭利益。
額外的信息
出版商的注意
beplay外围下载施普林格自然對出版的地圖和機構附屬的管轄權要求保持中立。
補充信息
權利和權限
開放獲取本文遵循創作共用署名4.0國際許可協議(Creative Commons Attribution 4.0 International License),該協議允許在任何媒體或格式中使用、分享、改編、分發和複製,隻要您給予原作者和來源適當的署名,提供創作共用許可協議的鏈接,並說明是否有更改。本文中的圖片或其他第三方材料包含在文章的創作共用許可中,除非在材料的信用額度中另有說明。如果材料不包含在文章的創作共用許可中,並且您的預期用途不被法律法規允許或超出了允許的用途,您將需要直接從版權所有者那裏獲得許可。欲查看此許可證的副本,請訪問http://creativecommons.org/licenses/by/4.0/.創作共用公共領域奉獻放棄書(http://creativecommons.org/publicdomain/zero/1.0/)適用於本文提供的數據,除非在數據的信用額度中另有說明。
關於這篇文章
引用這篇文章
喬治亞州的塞拉、科塞略、安托納、維吉尼亞州。et al。常染色體隱性多囊腎病:一例罕見新生兒報告PKHD1突變,快速腎腫大,早期死亡。斜體字J Pediatr46154(2020)。https://doi.org/10.1186/s13052-020-00922-4
收到了:
接受:
發表:
DOI:https://doi.org/10.1186/s13052-020-00922-4
關鍵字
- ARPKD
- 波特序列
- 新一代測序
- Genotype-phenotype相關性
- 道德