摘要
背景
肉堿棕櫚酰轉移酶1A (CPT1A)缺乏症是一種罕見的線粒體脂肪酸氧化(FAO)疾病,可導致低酮性低血糖和肝性腦病。它是由基因突變引起的CPT1A.到目前為止,中國僅報道了兩例有症狀的CPT1A缺陷病例。
案例展示
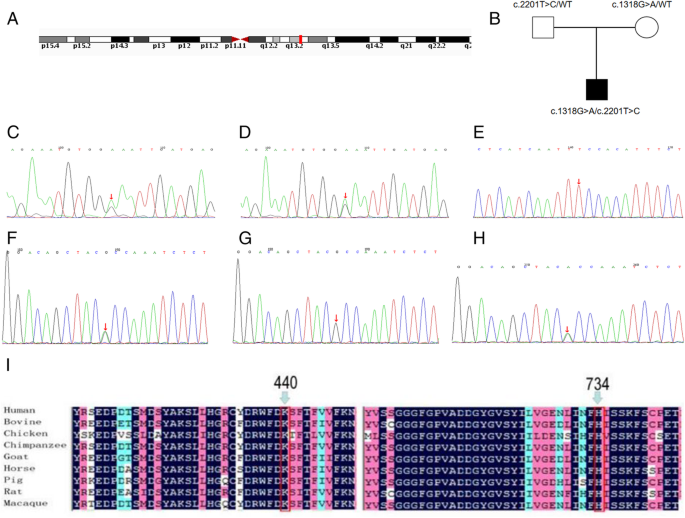
1例新生兒男性,無疾病相關臨床表現,通過新生兒篩查診斷為CPT1A缺陷。串聯質譜檢測到遊離肉堿水平升高,C0/(C16 + C18)比值顯著升高,隨後通過基因序列分析發現CPT1A突變。醫生建議患者采用低脂高蛋白飲食,並定期隨訪。在此後三年的隨訪中,患者表現出正常的生長速度和發育裏程碑。全外顯子組序列在患者中發現了兩種突變,C .2201 T > C (p.F734S)和C . 1318g > A (p.A440T)。此前報道的C .2201 T > C突變遺傳自他的父親,而C . 1318g > A突變則遺傳自他的母親。原始序列編碼的氨基酸殘基在不同物種中高度保守。通過分子建模分析,這些突變輕微地改變了蛋白質的三維結構,這表明它們可能是致病的。
結論
這是中國首例基於遊離肉堿診斷水平的新生兒篩查發現的CPT1A缺陷病例。3年隨訪提示,早期診斷和飲食管理可改善CPT1A患者的預後。此外,我們還發現了一個新的突變c.1318G > aCPT1A,和一個可能是中國血統特有的突變C. 2201 T > C。我們的研究擴大了這種罕見疾病的基因譜,為家庭遺傳谘詢和產前診斷提供了基礎。
背景
肉堿棕櫚酰轉移酶1A (CPT1A, EC# 2.3.1.21)缺乏症是一種罕見的肉堿循環常染色體隱性遺傳疾病(mim# 255120) [1].它是由編碼CPT1A的基因突變引起的,該基因位於染色體11q13.3。1)(2].這種酶對於長鏈脂肪酸酰基輔酶a酯運輸到線粒體中進行隨後的β -氧化至關重要。CPT-1A活性的喪失會降低線粒體內脂肪酸-氧化底物水平,從而影響能量生成[1].因此,CPT1A缺乏的患者在長時間禁食後通常會出現低酮性低血糖和肝性腦病。據報告,通常在出生後18個月內發病,隨後出現各種症狀,包括低酮症低血糖、嗜睡和癲癇發作[3.].在本報告中,我們報告了中國首例通過新生兒篩查發現的CPT1A缺陷症狀前病例,並發現了一種新的突變。此外,我們還發現了一種與這種疾病相關的新突變。
案例展示
臨床病史
在我院正常妊娠順產出生的一名男嬰,是他父母唯一的孩子。胎齡39周,Apgar評分10/ 1,10 / 5,10 /10,出生體重3500 g。從嬰兒身上采集足底血(三滴),滴在濾紙(Whatman S&S903)上,在出生第3天進行新生兒篩選測試,包括串聯質譜(MS/MS)。該男孩在出生30天時,因電話檢測結果異常被召回重新檢測(沒有具體報道)。44 d時,結果顯示血遊離肉堿(C0)水平升高128.1 mmol/L (ref < 50 mmol/L), C0/(C16 + C18)比值升高512.4 (ref < 42)。這些異常結果在出生後第51天再次檢測時得到證實,結果顯示遊離肉堿為65.86 mmol/L (ref < 100 mmol/L), C0/(C16 + C18)比值顯著升高為1423.97 (ref < 100),與CPT1A缺陷一致[3.].根據這些結果,男孩接受了徹底的檢查。頭顱MRI未見明顯異常,超聲心動圖正常。尿有機酸檢查2次均無異常。血液樣本的實驗室結果為:pH值為7.4;基礎過量,4.9 mmol/L(參考4.0-2.0 mmol/L);碳酸氫鹽,18.4 mmol/L(參考21.8-26.2 mmol/L);銨,29.2 mmol/L (ref < 47 mmol/L);乳酸,2.9 mmol/L(參考0.5-2.2 mmol/L);血栓細胞333 × 109/L(參考160-3609/ L);血紅蛋白,111克/升(參考110-160克/升);堿性磷酸酶,306 IU/L(參考55-425 IU/L);丙氨酸氨基轉移酶38.7 IU/L(參考5-50 IU/L);膽紅素,52.2 μmol/L(參考0-24 μmol/L);肌酸激酶,82 U/L(參考50-310 U/L);肌酸激酶同工酶MB, 30.5 U/L(參考0-25 U/L);血糖4.6 mmol/L(參考3.3-5.5 mmol/L)。3天後再次進行血檢,治療後結果恢複正常。當acylcarnitine恢複正常後,患者出院。CPT1A缺陷的診斷被考慮並通過基因序列確認(MyGenostics, Beijing, China)。
建議患者采用低脂高蛋白飲食(沒有精確的比例),並定期隨訪。建議食用深度水解奶粉、棕櫚油等富含中鏈脂肪酸的食品。在早期的情況下,當他生病時,低血糖是通過早期的葡萄糖輸注幹預預防的。每3個月,由專家對患者進行檢查,以評估其是否因與CPT1A缺陷相關的低酮性低血糖可能發作而遭受神經損傷。無運動遲緩和肌張力減退。在12個月大的時候,這個男孩已經能走路和說話了。在此後的3年隨訪中,他的精神運動發展與他的年齡相適應。
分子遺傳學研究
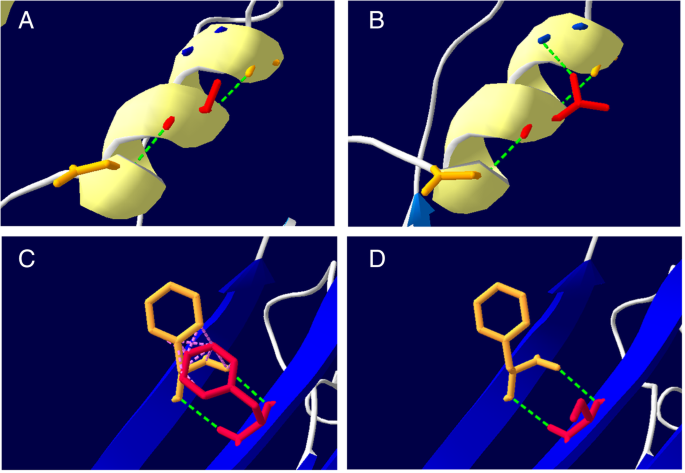
CPT1A(集合基因:ENST00000110090)經患者父母書麵知情同意後進行測序。結果顯示,外顯子18和11中分別出現C .2201 T > C (p.F734S)和C . 1318g > A (p.A440T)兩種突變。然後對患者的父母進行這些突變的家庭篩查。結果顯示,C .2201 T > C突變遺傳自其父親,而C . 1318g > A突變遺傳自其母親。1B,碳氫鍵)。這些變異沒有在SNP數據庫中列出(http://www.ncbi.nlm.nih.gov/projects/SNP/)、人類基因突變數據庫專業人員(http://www.hgmd.cf.ac.uk/ac/index.php).然而,c2201 T > C曾在中國一例CPT1A缺陷病例中被報道過[4,而c.1318G > A之前沒有報道過。根據PolyPhen2 (http://genetics.bwh.harvard.edu/pph2/), C .2201 T > C突變被預測為“可能具有破壞性”(得分,0.995),C . 1318g > A突變被預測為“可能具有破壞性”(得分,0.875),這表明這兩種突變都可能導致疾病。序列數據顯示,在我們的患者中檢測到的兩種突變都是導致p.F734S和p.A440T替換的錯義突變。進一步,我們通過分子建模來預測這些突變對CPT1A蛋白結構的影響(圖。2).我們發現,Thr440替換為Ala440會導致Thr440- met436之間增加一個氫鍵,而Ser734替換為Phe734會導致Ser734- phe549之間失去疏水鍵力。由於氫和疏水鍵在維持蛋白質空間構象和穩定性方麵起著重要作用,這些細微的空間結構變化可能會影響蛋白質的功能。這些數據表明,導致這些替換的突變可能不是多態性,而是致病突變。
討論
CPT1A缺乏是一種罕見的影響脂肪酸氧化(FAO)的代謝性疾病,在大多數情況下,患者隻有在出現臨床症狀後才被診斷。大多數患者在2歲時出現這些症狀,由禁食或疾病引起的低酮症性低血糖[5].這通常伴有肝功能障礙;亦可能出現短暫性脂血症及腎小管酸中毒[1].我們的患者在3天大時進行了新生兒篩查,早期檢測到CPT1A缺乏的指標,即遊離肉堿增加和C0/(C16 + C18)比值顯著增加。基因序列分析證實了CPT1A缺陷的診斷。建議飲食管理和避免長時間禁食以改善患者的臨床預後[5].因此,到目前為止,我們的患者發育正常,沒有嚴重的代謝危機。提示該病的早期診斷對預後至關重要。
CPT1A缺陷是由基因編碼突變引起的CPT1A。分析CPT1A是準確診斷的必要條件。到目前為止,已有超過30個突變CPT1A,對CPT1A缺陷負有責任,已被確認[6].我們的患者攜帶兩種錯義突變C .2201 T > C (p.F734S),此前曾在一名中國患者中報道過[4和c.1318G > A (p.A440T),一種新的突變。CPT1A中734和440位點的氨基酸殘基在牛、雞、黑猩猩、山羊、馬、豬、大鼠和獼猴中高度保守。1I),提示這些位點在CPT1A的正常功能中起關鍵作用。根據預測軟件的分析,這些突變並不表現為多態性,而更有可能是致病突變。
根據表中地理區域,我們列出了目前報告的CPT1A突變1.除了c.2129G > a和c.1436C>T外,大多數突變似乎都是獨特的或僅局限於少數係譜。[2].而c.2129G > A (p.G710E)是一種與疾病嚴重程度相關的純合突變,主要在美國阿拉斯加人和胡特人人群中發現[19].c.1436C > T突變(p.P479L)在加拿大北部、格陵蘭島、哥倫比亞以及阿拉斯加土著人口中更為常見[20.].在這些人群中,大多數受影響的個體都是這種變異的純合子[20.].p.P479L致病性變異通常被認為是非致病性的,其殘餘酶活性相對較高,但仍與嬰兒死亡率有關[18,21].外顯子和多外顯子缺失的報道很少[17].在其他地區,這種疾病的發病率似乎相當低。這種區域差異的真正含義仍然未知。迄今為止,中國僅報道了兩例CPT1A缺陷病例[4,8],兩者均在患者(> 1歲)出現低血糖症狀後診斷,隨後出現腹瀉和發熱。此外,致病的基因幾乎完全異質性CPT1A每個受影響家庭的變異表現出新的變異CPT1A[1].因此,整體分析CPT1A需要確認新生兒篩查異常,需要仔細解釋異常基因型的致病性質[7,9].p.F734S突變曾在1例中國雜合子基因突變患者中報道過,可能是中國特有的。
不同的突變導致不同的結構和功能變化。錯義突變p.A275T, p.A414V, p.Y498C ofCPT1A位於遠離活性位點的位置,主要影響蛋白質本身和/或酶-底物複合物的穩定性,從而降低了催化效率。相比之下,突變體p.G709E和p.G710E影響甘氨酸殘基,甘氨酸殘基對催化位點的疏水核心結構和CPT亞型的鏈長特異性至關重要,在不影響酶定位和穩定性的情況下,極大地損害了CPT1A的催化功能[22].像p.R357W, p.L484P和p.C304W這樣的突變與蛋白質穩定性下降有關。p.C304W, p.P479L和p.delR395可使CPT1A失活[18].p.P479L變異影響酶的丙二酰輔酶a結合位點,導致CPT1A活性降低25% ~ 50%。另一項研究發現,突變體p.E360G導致CPT1A蛋白水平下降[11].據報道,CPT1A中保守的精氨酸和色氨酸突變會降低酶活性,如Arg388、Arg451、Trp391和Trp452。總的來說,所有導致功能或穩定性喪失的CPT1A突變都存在於c端催化結構域(123-773 aa) [23].我們的患者是誤義突變,導致p.F734S和p.A440T替換。通過三維建模證明突變p.F734S和p.A440T可能改變蛋白質的空間結構,從而影響蛋白質的功能。
因此,新生兒篩查項目非常重要,該項目允許在新生兒分解代謝時,在幹燥全血斑點中早期發現代謝標誌物[3.].新生兒CPT1A缺陷篩查現在在美國32個州是強製性的,在另外16個州和加拿大5個省也可進行[24].在意大利,自2016年以來,在全國範圍內對約40種遺傳代謝性疾病實施了強製性的新生兒擴大篩查[25].然而,CPT1A缺陷篩查並不包括在中國每個省份的新生兒篩查計劃中。常規的新生兒代謝篩查項目包括苯丙酮尿症、先天性甲狀腺功能減退症、遺傳性葡萄糖-6-磷酸脫氫酶缺乏症、先天性腎上腺增生症、地中海貧血和新生兒聽力篩查。自2016年以來,中國中部(湖北省)新生兒篩查項目將采用質譜/質譜技術篩查脂肪酸氧化障礙納入其中,目前已對12萬多名新生兒進行了檢測。我們采用的MS/MS掃描(API3200MD,AB, America)方法為多反應監測(MRM)。但湖北省目前僅建立了5個大型新生兒篩查中心,部分地區反饋機製不完善,可能導致篩查時間過長、診斷延誤。如果出現異常結果,孩子將被轉到兒科內分泌科醫生進行進一步檢查。
CPT1A缺陷的特征是所有酰肉堿的合成顯著減少,以及新生兒篩查血斑上遊離CO和C0/(C16 + C18)水平增加。MS/MS用於檢測遊離肉堿與C16 + C18比值升高,這是CPT1A患者的特征[3.].尿液有機酸在急性危險期及隨後幾天顯示十二氧化二酸水平升高[13].本例尿有機酸檢查結果正常,可能非急性期。在這個病例中,在出生後3天采集足底血,30天出現異常,這是一個漫長而危險的時間。我省新生兒篩查檢查時間有待改進。
根據澳大利亞、德國和美國新生兒篩查項目的數據,CPT1A缺陷的發生率可能低至1:75萬至1:20 00萬[26].阿拉斯加新生兒篩查項目中CPT1A c.1436C > T突變患病率較高[27].有證據表明,帶有這種變異的純合子嬰兒的空腹耐受性受損[28]和嬰兒死亡風險增加[7].c. 1436 c > T突變152例純合子嬰兒中有5例死亡,219例雜合子嬰兒中2例死亡,245例非攜帶者中0例死亡。在一項對具有全基因組高覆蓋率序列的北極人口的研究中,CPT1A變體被確定為有害的,並與周邊北極人口的嬰兒死亡率增加有關[21].到目前為止,中國隻有兩例無死亡病例。本病例是中國首例通過新生兒篩查發現的症狀前CPT1A缺陷病例。隨著新生兒MS/MS篩查在全國範圍內越來越全麵,檢出率可能會更高。
CPT1A缺乏是一種長鏈脂肪酸氧化紊亂。大多數個體的殘酶活性為1-5% [23].當能量需求增加時,臨床表現通常出現在伴有發熱或胃腸道疾病的個體;症狀通常很快出現。應避免長時間禁食,或應提供足夠水平的葡萄糖,特別是在發燒或胃腸道疾病期間。即使在CPT1A缺乏的個體中未見不良藥理反應的報道,也不應給予丙戊酸和水楊酸等具有潛在肝毒性的藥物[2].以往的報道表明,嚴格的飲食習慣可使缺乏cpt1a的嬰兒過上正常生長發育的健康生活[3.].與上述報道一致,我們的患者早期診斷,及時幹預,生長趨勢正常。然而,這種疾病可能沒有臨床試驗。新生兒代謝篩查對早期診斷和治療很重要。考慮到這種方法的簡單性,它可以在全國範圍內實施。此外,在目前的情況下,建議父母進行遺傳谘詢,如果他們希望再生一個孩子。
結論
總之,我們使用MS/MS進行新生兒篩查來診斷症狀前新生兒的CPT1A缺陷。早期診斷和飲食管理改善了患者的預後。因此,未來需要在全國範圍內擴大新生兒MS/MS篩查的範圍,提高檢測時間的速度,完善反饋機製。此外,我們還發現了一個新的突變c.1318G > aCPT1AC .2201 T > C突變可能是中國人獨有的。因此,我們的發現擴大了這種罕見疾病的基因譜,為家庭遺傳谘詢和產前診斷提供了基礎。
數據和材料的可用性
本研究中使用和分析的數據集可根據合理要求從通訊作者處獲得。
改變曆史
2021年9月21日
縮寫
- CPT1A:
-
肉堿palmitoyltransferase 1
- 糧農組織:
-
脂肪酸氧化
- 女士/小姐:
-
串聯質譜
- MRM:
-
多反應監測
參考文獻
Bennett MJ, bororiack RL, Narayan S, Rutledge SL, Raff ML. CPT 1A的新突變定義了肝肉堿棕櫚酰轉移酶I缺乏症的分子異質性。中華分子生物學雜誌2004;82(1):59-63。https://doi.org/10.1016/j.ymgme.2004.02.004.
華盛頓大學西雅圖分校。Bennett MJ, Santani AB.肉堿棕櫚酰轉移酶1a缺乏。見:Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Bean LJH,等,編。GeneReviews (R)。西雅圖:華盛頓西雅圖大學,2005。https://www.ncbi.nlm.nih.gov/books/NBK1527/
肉堿棕櫚酰轉移酶- 1a缺陷:經典和北極變種的觀察。新生兒護理雜誌,2012;12(1):23-7。https://doi.org/10.1097/ANC.0b013e318242df6d.
董超,胡勇,沈東,等。1例肉堿棕櫚酰轉移酶1A缺乏症的臨床特征及遺傳分析。中華醫學與Genet雜誌2017;34(2):228-31。(在中國)。https://doi.org/10.3760/cma.j.issn.1003-9406.2017.02.017.
李波夫,金豔梅,金誌華,金GH,金JM,金JH,等。肉堿棕櫚酰轉移酶1A缺乏的非典型表現:肝脾腫大和腎腫大。兒科胃腸病學雜誌2015;60(3):e19-22。https://doi.org/10.1097/MPG.0b013e3182a95a42.
田穀R,阪本O,新井N,小林H,長穀川Y,山口S,等。串聯質譜法檢測日本新生兒肉堿棕櫚酰轉移酶I (CPT I)缺乏症症狀前病例的分子分析。大腦發育。2010;32(5):409 - 11。https://doi.org/10.1016/j.braindev.2009.03.004.
Gessner BD, Gillingham MB, Johnson MA, Richards CS, Lambert WE, Sesser D,等。阿拉斯加本地嬰兒肉堿棕櫚酰轉移酶1A c.1436C→T序列變異的患病率和分布。J Pediatr。2011;158(1):124 - 9。https://doi.org/10.1016/j.jpeds.2010.07.031.
張輝,袁元紅,唐蓮,等。肉堿棕櫚酰轉移酶1A缺乏症1例臨床特點及CPT1A基因突變分析。兒科藥學雜誌,2019。(11):汽車出行。(在中國)。DOI:https://doi.org/10.13407/j.cnki.jpp.1672-108X.2019.11.007.
鮑奇L,隆德AM, Wibrand F,等。丹麥新生兒篩查發現的一名症狀前肉堿棕櫚酰轉移酶1 (CPT1)缺乏症病例的隨訪樣本中血漿遊離肉堿和酰基肉堿正常水平。JIMD眾議員2012;3:11-5。https://doi.org/10.1007/8904_2011_35.
芬蘭肉堿棕櫚酰轉移酶1A缺乏症常見突變的載體頻率及長期隨訪J Pediatr》2012。160 (3): 473 - 479. - e1。DOI:https://doi.org/10.1016/j.jpeds.2011.08.032.
小川E,金澤M,山本S,大塚S,小川A,大竹A,等。肉堿棕櫚酰轉移酶IA缺乏症兩種突變的表達分析。中國生物醫學工程學報。2002;47(7):342-7。https://doi.org/10.1007/s100380200047.
金澤明,小川明,高洋一,大武一,小野雅,雷氏樣病患兒肝肉堿棕櫚酰轉移酶I缺乏症的分子分析,中華遺傳雜誌。金屬底座。第23(增刊1)(2000)229(摘要)。https://doi.org/10.1023/A:1017326813602.
科曼SH, Waterham HR, Gutman A, Jakobs C, Wanders RJ。肝髒肉堿棕櫚酰轉移酶I缺乏症的新代謝和分子發現。中華分子生物學雜誌2005;86(3):337-43。https://doi.org/10.1016/j.ymgme.2005.07.022.
IJlst L, Mandel H, Oostheim W, Ruiter JP, Gutman A, Wanders RJ。肝肉堿棕櫚酰轉移酶I缺乏的分子基礎。中華臨床醫學雜誌。1998;102(3):527-31。https://doi.org/10.1172/JCI2927.
Stoler JM, Sabry MA, Hanley C, Hoppel CL, Shih VE。成功長期治療肝肉堿棕櫚酰轉移酶I缺乏症和一種新的突變。中華醫學雜誌2004;27(5):679。https://doi.org/10.1023/B:BOLI.0000042979.42120.55-84年。
Dowsett L, Lulis L, Ficicioglu C, Cuddapah S.基因檢測在確認長鏈脂肪酸疾病異常新生兒篩查中的應用:肉堿棕櫚酰轉移酶1A (CPT1A)缺乏症的一個遺漏病例。《新生兒篩查雜誌》2017;3(2)。https://doi.org/10.3390/ijns3020010.
Gobin S, Bonnefont JP, prip - busus C, Mugnier C, Ferrec M, Demaugre F,等。人肝肉堿棕櫚酰轉移酶1基因(CPT1A)的組織與低酮型低血糖症新突變的鑒定。哼麝貓。2002;111(2):179 - 89。https://doi.org/10.1007/s00439-002-0752-0.
Brown NF, Mullur RS, Subramanian I,等。6例患者L-CPT I缺乏症的分子特征:對天然酶功能的洞察。血脂雜誌2001;42(7):1134-42http://www.jlr.org/content/42/7/1134.long.https://doi.org/10.1016/s0022 - 2275 (20) 31604 - 7.
prip - busus C, Thuillier L, Abadi N, Prasad C, Dilling L, Klasing J,等。胡特人群落中一個獨特的肉堿棕櫚酰轉移酶1A突變的分子和酶特性。中國生物醫學工程學報,2001;29(1):1 - 6。https://doi.org/10.1006/mgme.2001.3176.
Park JY, Narayan SB, Bennett MJ。常見肉堿棕櫚酰轉移酶1A 1436(C>T)突變的分子檢測。臨床化學檢驗醫學。2006;44(9):1090-1。https://doi.org/10.1515/CCLM.2006.196.
Clemente FJ, Cardona A, Inchley CE。對北極人群中CPT1A有害突變的選擇性掃描。中國生物醫學工程學報,2014;29(5):563 - 566。https://doi.org/10.1016/j.ajhg.2014.09.016.
Gobin S, Thuillier L, Jogl G, Faye A, Tong L, Chi M,等。肉堿棕櫚酰轉移酶1A缺乏的功能和結構基礎。中國生物化學雜誌2003;278(50):50428-34。https://doi.org/10.1074/jbc.M310130200.
Isabel R. Schlaepfer, Molishree Joshi, cpt1a介導的脂肪氧化,機製和治療潛力。內分泌學。2020;161(2):0013 - 7227。https://doi.org/10.1210/endocr/bqz046.
Fohner AE, Garrison NA, Austin MA, Burke W.肉堿棕櫚酰轉移酶1A P479L與嬰兒死亡:新數據的政策含義。地中海麝貓。2017;19(8):851 - 857。DOI:https://doi.org/10.1038/gim.2016.202.
la Marca G. la organización del cribado新生兒和意大利:comparación con Europa y el resto del mundo[意大利新生兒篩查計劃:與歐洲和其他國家的比較]。Rev Esp Salud Publica. 2021 26;95:e202101007。西班牙語。PMID: 33496274。
Lindner M, Hoffmann GF, Matern D.新生兒脂肪酸氧化障礙篩查:專家會議的經驗和建議。中華中醫藥雜誌2010;33(5):521-6。https://doi.org/10.1007/s10545-010-9076-8.
Collins SA, Sinclair G, McIntosh S, Bamforth F, Thompson R, Sobol I,等。肉堿棕櫚酰轉移酶1A (CPT1A) P479L在育空、西北地區和努納武特活產兒中的患病率。中華分子生物學雜誌,2010;29(2-3):394 - 394。https://doi.org/10.1016/j.ymgme.2010.07.013.
Gillingham MB, Hirschfeld M, Lowe S, Matern D, Shoemaker J, Lambert WE, Koeller DM.具有常見肉堿棕櫚酰轉移酶1A序列變異的阿拉斯加土著兒童的空腹耐受性受損。中國生物醫學雜誌,2011;54(4):361 - 361。DOI:https://doi.org/10.1016/j.ymgme.2011.06.017.
確認
我們感謝患者及其家人的貢獻。
資金
這項研究沒有得到任何基金支持。
作者信息
作者和聯係
貢獻
YG撰寫了手稿並研究了數據。HF研究了數據,並對手稿做出了貢獻。FY指導並監督了這項研究。所有作者閱讀並批準了最終稿件。
相應的作者
道德聲明
倫理批準和同意參與
本研究經湖北省婦幼保健院倫理委員會批準。所有參與者都給予了書麵知情同意參加本研究。
同意出版
這家人已經書麵同意發表案件報告。
相互競爭的利益
作者聲明他們沒有競爭利益。
額外的信息
出版商的注意
beplay外围下载施普林格自然對出版的地圖和機構附屬的管轄權要求保持中立。
權利和權限
開放獲取本文遵循創作共用署名4.0國際許可協議(Creative Commons Attribution 4.0 International License),該協議允許在任何媒體或格式中使用、分享、改編、分發和複製,隻要您給予原作者和來源適當的署名,提供創作共用許可協議的鏈接,並說明是否有更改。本文中的圖片或其他第三方材料包含在文章的創作共用許可中,除非在材料的信用額度中另有說明。如果材料不包含在文章的創作共用許可中,並且您的預期用途不被法律法規允許或超出了允許的用途,您將需要直接從版權所有者那裏獲得許可。欲查看此許可證的副本,請訪問http://creativecommons.org/licenses/by/4.0/.創作共用公共領域奉獻放棄書(http://creativecommons.org/publicdomain/zero/1.0/)適用於本文提供的數據,除非在數據的信用額度中另有說明。
關於這篇文章
引用這篇文章
甘豔,於芳,方宏。通過新生兒篩查檢測到的肉堿棕櫚酰轉移酶1A新突變為中國一例症狀前病例:一例病例報告。斜體字J Pediatr47154(2021)。https://doi.org/10.1186/s13052-021-01094-5
收到了:
接受:
發表:
DOI:https://doi.org/10.1186/s13052-021-01094-5
關鍵字
- 肉堿棕櫚酰轉移酶1A缺乏
- 串聯質譜
- 基因突變
- 新生的屏幕
- 病例報告