摘要
背景
糖原儲存病XII型是一種罕見的代謝性疾病,由醛縮酶a缺乏症引起肌糖原積累,以橫紋肌溶解和溶血性貧血為危象。在極少數病例中,橫紋肌溶解危機是由發燒和/或運動引起的,並可伴有急性溶血性貧血。雖然目前還沒有針對這種疾病的治療方法,但其他形式的糖原儲存疾病的管理指南建議采用營養療法,以避免低血糖或預防運動引起的橫紋肌溶解症。
案例展示
在這個病例報告中,我們描述了一個14歲男孩的疾病的新表型,以癲癇和橫紋肌溶解為特征。除了抗癲癇治療外,我們還提出了一種基於生酮飲食的新治療方法,以便為骨骼肌和神經元提供能量基質。
結論
患者對抗癲癇治療和飲食治療的耐受性良好,患者表現出良好的依從性。這導致了疾病的減速,沒有其他急性發作的癲癇和橫紋肌溶解,沒有觀察到任何副作用。
劇情簡介
一例報告患者醛縮酶A缺乏症的新表型特征為癲癇和橫紋肌溶解,治療生酮飲食。
背景
糖原儲存病12型(GSD XII)是一種由醛縮酶A (ALDOA)缺乏症引起的超罕見常染色體隱性遺傳病,以溶血性貧血和橫紋肌溶解伴或不伴肌病或智力障礙為特征。醛縮酶是一種可熱性糖酵解酶,負責將果糖-1,6-二磷酸可逆轉化為甘油醛-3-磷酸和磷酸二羥丙酮[1].
三種醛縮酶同工酶(A、B和C)已知由65個不同的基因編碼。它們具有不同的組織分布,並且在一生中表達差異[2].
醛縮酶A主要存在於肌肉、紅細胞和大腦中;醛縮酶B定位於肝髒;而醛縮酶C與醛縮酶A一起出現在中樞神經係統中,醛縮酶A是人腦中表達最多的異構體[3.,4].
1973年Beutler等人報道了第一例醛縮酶A缺乏症。[5].常見表型特征為發熱或運動引起的橫紋肌溶解和溶血性貧血、肌病、輕微認知功能障礙(學習障礙或語言習得延遲)[5- - - - - -9].對於這種罕見的疾病,沒有任何藥物療法顯示有效,隻能通過支持和對症治療,如紅細胞輸血、水合和康複。
在本病例報告中,我們描述了一種以癲癇和橫紋肌溶解為特征的14歲男孩GSD XII的新臨床表型。我們還提出了預防癲癇危機的藥理學方法,以及基於生酮飲食的飲食措施。
案例展示
先證者是一名14歲的男孩,當時診斷為醛縮酶缺乏症。他是一對沒有血緣關係的阿爾巴尼亞夫婦的第三個孩子。
男嬰是在一次順利的懷孕和分娩後出生的,生長發育和神經發育正常。2歲時,他因嚴重貧血住進醫院,需要輸血。不幸的是,沒有關於這一事件的數據。
14歲零9個月時,患兒首次出現全身性強直陣攣性癲癇發作,並伴有意識喪失,隨後出現深色“可口可樂”色尿液。實驗室檢查顯示肌紅蛋白尿伴高轉氨酶血症和高cpk血症(AST 4559 U/I正常0-40;ALT 1198 U/l,正常0-40;CPK 138,000 U/l,正常0-170)。當時,在地拉那“特蕾莎修女”大學醫院中心進行了超聲心動圖、腹部超聲、腦CT和腦電圖,未發現異常。
他的家族史顯示,他的一個哥哥在14歲時被診斷患有癲癇和橫紋肌溶解症,在17歲時死於突然的癲癇持續狀態。
考慮到臨床和家族史,在懷疑代代性疾病的情況下,對基因ALDOA的純合致病變異c.1001C > T (p.Ala334Val)進行了測序,並根據Centogene (Rostock, Germany)和ACMG (ACMG SF v2.0 2016年更新)的建議將其定位為可能致病(2類)。Polyphen軟件預測這一變化“可能具有破壞性”。在此基礎上,診斷為GSD XII。分離研究證實了父母和弟弟的雜合性。
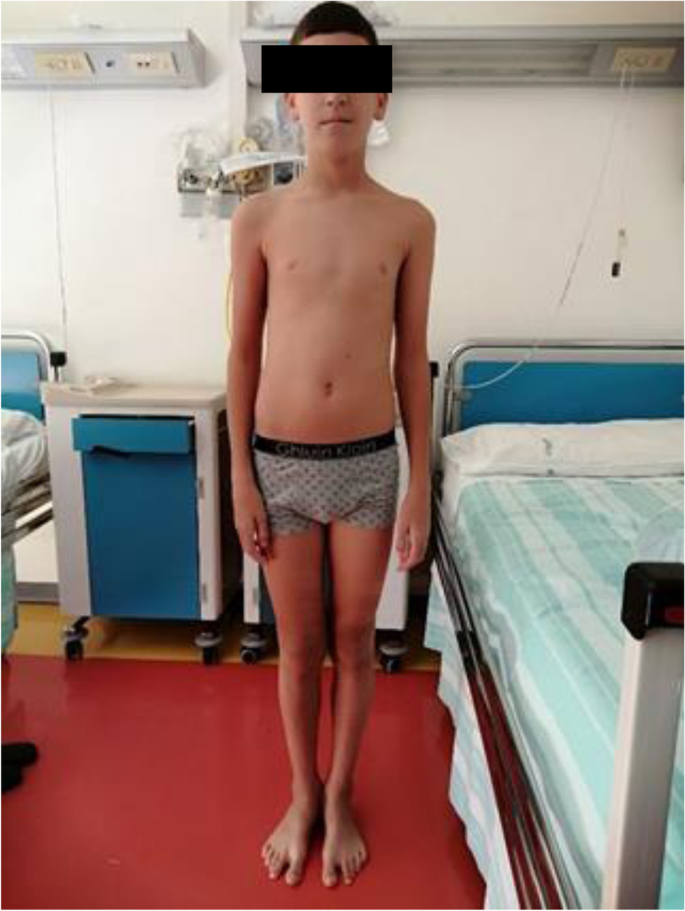
在15歲時,該男孩出現了兩次嚴重的發作間隔一個月,隨後橫紋肌溶解和肌紅蛋白尿自發解決。CPK值分別為13.8萬U/I和11560 U/I。此時,患者被轉到意大利安科納的Salesi兒童醫院代謝疾病中心進行進一步評估。入院時,孩子總體狀況良好。他沒有表現出發育遲緩或明顯的畸形特征。體重41 kg(3°p),身高156 cm(90°p)。體檢時,患者肌肉量減少,肌張力正常,輕度背-腰右側凸側凸(圖2)。1而且2).他沒有表現出任何運動限製,但隻有輕度彌漫性肌痛,主要在腰部。患者未出現肝腫大。實驗室檢查結果如下:血紅蛋白11.1 g/dl;血球容積計32.9%;MCV 83 fl,白細胞計數8310/mmc,血小板計數272,000/mmc。CPK濃度顯著升高(14000 U/l)。AST 465 U/l;ALT 375 U/l;乳酸脫氫酶542 U/l(正常0-325)。 Urinalysis and arterial blood gas analysis were normal. During hospitalization, the child presented two more critical episodes. The first episode occurred in the early morning, during sleep, in apyrexia. He presented with generalized tonic–clonic seizures which resolved after administration of rectal diazepam. Laboratory examination revealed severe metabolic acidosis (Ph 7.2, HCO3- 19 mmol/l, base excess -5.7 mmol/l, anion gap 15 mmol/l), mild renal insufficiency (creatinine level 0.95 mg/dl, normal 0.2–1.3), hyperuricemia (16.8 mg/dl, normal 2.5–7) and hyperCPKemia (33.306 U/l), and hypermyoglobinemia (1148 ng/ml, normal 0–110). Adequate hydration was practiced and rasburicase was prescribed with normalization of urinary biomarkers. An EEG was performed immediately after the crisis and no abnormalities were detected. In contrast, the EEG performed 24 h post-crisis showed sporadic wide slow waves. The second episode, similarly to the first, occurred early in the morning, during sleep. The patient presented metabolic acidosis (ph 7.28, HCO3- 28.7 mmol/l, anion gap 21, EB -7, lactic acid 7.6), hyperuricemia (13.2 mg / dl) and hyperCPKemia (41.870 U/l) and hypermyoglobinemia (1738 ng/ml). As with the previous episode he was treated with adequate hydration and rasburicase therapy.
雖然代謝性酸中毒和高尿酸血症立即得到解決,但肌紅蛋白尿和橫紋肌溶解指數持續升高,僅在隨後幾天恢複到基線水平(CPK 1612U /l,肌紅蛋白138 ng/ml)。考慮到患者有清晨癲癇發作史,並伴有代謝性酸中毒,給予正常熱量飲食,特別強調由吸收緩慢的碳水化合物(玉米澱粉)組成的午夜餐。這種營養幹預與抗驚厥治療一起引入,包括每日兩次的Leviteracetam。
隨後,患者被轉到羅馬Ospedale pediatric Bambino Gesù的代謝科進行進一步的診斷和治療評估。在急性期和幹預期間,代謝工作總是正常的,特別是血漿和尿氨基酸,血漿酰基肉堿剖麵,尿有機酸,尿碳水化合物色譜。進行24小時空腹試驗,血糖正常,但注意到CPK升高,心電圖ST段下降。營養恢複後,心電圖和CPK值均恢複正常。同時,該男童出現輕度咽痛和鼻漏症狀,Covid-19檢測呈陽性。考慮到許多研究強調生酮飲食對許多神經疾病和肌肉GSD的潛在積極影響III, V, VII [10,11,12,13,14病人開始吃生酮飲食。從生酮飲食開始5個月後,患者沒有經曆任何進一步的代謝失代償,正如電話采訪所報道的那樣。
材料與方法
常規血液學檢查、生化和遺傳分析、腦電圖和磁共振成像均采用標準技術進行。
飲食:以生酮比例(脂肪:蛋白質+碳水化合物)為0.9:1開始誘導生酮,逐步增加至2.5:1。2.5:1生酮飲食的宏量營養素組成為7%蛋白質(1,1 g/kg), 83%脂肪和10%碳水化合物,符合推薦的每日能量攝入量(總2900 kcal, 62 kcal/kg/die)。通過每日毛細血管血和尿酮測量控製生酮飲食的開始。為了實施生酮飲食,準備了考慮到患者阿爾巴尼亞血統的後續培訓和課程材料,並將特定國家的食譜修改為生酮變體。
抗癲癇藥物包括Leviteracetam,起始劑量為250mg bd,逐步增加至1gr bd。藥物濃度的治療範圍為22.69 μg/mL。
討論與結論
與之前描述的病例不同,我們的患者及其極有可能死於同一種疾病的兄弟在代謝失代償期間表現出嚴重的神經損傷和癲癇發作。癲癇發作發生在明顯健康的時期,夜間禁食,清晨丙酮呼吸和伴隨的乳酸酸中毒血氣分析。迄今為止,GSD XII尚未描述癲癇。然而,中樞神經係統的普遍參與可以通過觀察到醛縮酶A是人腦中表達最多的異構體來解釋[4]。此外,輕度智力障礙也被描述為[6,7,9,15揭示了在某些情況下慢性微妙的神經元參與。
manamoune等人在2014年描述了一種類似的Aldolase a致病性變異,影響了3例由發熱性疾病引發的偶發性橫紋肌溶解的兄弟姐妹。他們表明,潛在的機製涉及高溫下醛縮酶A缺乏症的加劇,但熱性是非常可變的,並且是組織特異性的[15].這與我們患者的臨床表型一致。事實上,危機從來都不是由發燒引起的。
之前描述的醛縮酶A缺乏症的另一個重要特征是溶血性貧血。在我們的案子中,先證者和他的兄弟都沒有記錄在案的溶血性貧血。患者僅表現為輕度正常細胞性貧血,溶血指數在正常範圍內,除2歲外,未進行過輸血或鐵治療,但與本病無關。與其他報道的另一個差異是我們的患者在代謝失代償期間存在乳酸性酸中毒。然而,這一特征可以用疾病的糖酵解中斷來解釋。
據我們所知,文獻中沒有關於Aldolase A缺乏症患者的有效治療的報道,除了一篇報道顯示補充精氨酸可以減少體外橫紋肌溶解[15].
我們的病人似乎受益於抗癲癇治療和避免夜間玉米澱粉禁食,開始。隨後,為了減少糖原在肌肉中的儲存,並提供獨立於糖原分解的能量代謝替代途徑,向患者提出了生酮飲食。生酮飲食是一種特殊的高脂肪、限製碳水化合物的飲食,它模仿禁食的代謝作用,以使酮體成為肝外組織的重要能量來源。這種營養療法引起了人們對難治性癲癇、肌萎縮性側索硬化症、阿爾茨海默病和帕金森病以及一些線粒體病的極大興趣[16].
以前有關於生酮飲食用於其他類型的肌肉性GSD患者的報道,如III型、V型和VII型。更具體地說,一名2歲嬰兒表現為家族性GSD III合並心肌病,實驗用合成酮體(D,L-3-OH丁酸酯)組合作為替代能源和2:1的生酮飲食治療,以減少糖原積累。這導致了心肌病的改善和肝髒大小的正常化,正常生長,沒有不良反應的報道[10].在另一份報告中,2名GSD IIIa成年患者接受生酮飲食治療,導致CK降低和血糖穩定。此外,它對疾病的進展有積極的影響,改善心肌病[11].
類似的關於GSD V和GSD VII患者的軼事報告顯示,當患者處於禁食狀態而不是進食狀態時,有氧能力和活動耐受性有所改善,這表明替代燃料基質,如酮體,可以潛在地緩解肌肉症狀[12].Løkken等人進行了一項開放標簽試點研究,展示了生酮飲食如何改善脂肪氧化率、運動能力和主觀症狀[13].
我們的病人表現出警覺狀態和虛弱的重要改善。隨訪5個月,患者未出現新的代謝失代償或癲癇危象。
總之,我們描述了一種新的GSD XII表型,其特征為癲癇發作、橫紋肌溶解和乳酸性酸中毒,沒有溶血性貧血,沒有發燒或運動等觸發因素。生酮飲食為肌肉和神經元提供葡萄糖的替代能源燃料,在預防代謝失代償方麵有效和安全。因此,GSD XII型可能被認為是生酮飲食的一種新的適應證。需要更長的隨訪來驗證我們的初步發現。
數據和材料的可用性
本研究中使用和/或分析的數據集可根據合理要求從通訊作者處獲得。
縮寫
- 德牧:
-
糖原貯積病
- ALDOA:
-
醛縮酶一
參考文獻
甘布林SJ,戴維斯GJ,格萊姆斯JM,傑克遜RM,小朋友JA,沃森HC。人醛縮酶的活性和特異性。中華分子生物學雜誌。1991;19(4):573-6。https://doi.org/10.1016/0022 - 2836 (91) 90650 - u.
Tolan DR, Niclas J, Bruce BD, Lebo RV。人類醛化酶- a, -B, -C和-假基因染色體位置的進化意義。王誌剛,王誌剛。2007;21(5):389 - 397。
李誌剛,李誌剛。果糖二磷酸醛縮酶變體在生物係統中的分布。生物化學,1969;8(1):109 - 21所示。https://doi.org/10.1021/bi00829a016.
Buono P, D 'Armiento FP, Terzi G, Alfieri A, Salvatore F.醛縮酶A和C在人中樞神經係統中的差異分布。神經細胞雜誌,2001;30(12):957-65。https://doi.org/10.1023/a:1021828421792.
Beutler E, Yoshida a .人葡萄糖-6-磷酸脫氫酶變體:補充表格。人類生殖學報。1973;37(2):151-5。https://doi.org/10.1111/j.1469-1809.1973.tb01823.x.
王誌強,王誌強,王誌強,等。日本家族中與遺傳性溶血性貧血相關的紅細胞醛縮酶缺乏症兩例。中華血液學雜誌,1981;11(4):425-37。https://doi.org/10.1002/ajh.2830110412.
李文傑,李文傑,等。中華醫學雜誌,1996;36(4):516 - 516。https://doi.org/10.1056/NEJM199604253341705.
姚東東,陶蘭,穆雷,等。紅細胞/肌醛縮酶同工酶ALDOA(Arg303X/Cys338Tyr)基因的複合雜合突變引起的溶血性貧血和嚴重橫紋肌溶解症。血。2004;103(6):2401 - 3。https://doi.org/10.1182/blood-2003-09-3160.
王曉燕,王曉燕,王曉燕,等。醛縮酶A缺乏症新發病例報告及文獻複習。分子遺傳學與代謝研究。2021;27:100730。https://doi.org/10.1016/j.ymgmr.2021.100730.
Valayannopoulos V, Bajolle F, Arnoux J-B,等。d, l-3-羥基丁酸酯成功治療糖原儲存病iii型嚴重心肌病。生酮和高蛋白飲食兒童,2011;70(6):638-41。https://doi.org/10.1203/PDR.0b013e318232154f.
Fischer T, Njoroge H, Och U, Klawon I, Marquardt T.生酮飲食治療成人糖原病IIIa型(Morbus Cori)臨床營養實驗,2019;28:83-91。https://doi.org/10.1016/j.yclnex.2019.09.004.
Reason SL, Godfrey RJ。生酮飲食在糖原儲存疾病V和VII中代謝錯誤的影響最小化的潛力。《內分泌糖尿病雜誌》2020;27(5):283-90。https://doi.org/10.1097/MED.0000000000000567.
Løkken N, Hansen KK, Storgaard JH, Ørngreen MC, Quinlivan R, Vissing J.對麥卡德爾病患者滴定改良生酮飲食:初步研究。中國生物醫學工程雜誌。2020;43(4):778-86。https://doi.org/10.1002/jimd.12223.
馬蒙,馬華,李誌強,等。一種可熱性醛縮酶突變體可引起發熱誘導的複發性橫紋肌溶解,但無溶血性貧血。威爾基·奧姆,主編,plos genet。2014; 10 (11): e1004711。https://doi.org/10.1371/journal.pgen.1004711.
Paoli A, Bianco A, Damiani E, Bosco G.生酮飲食在神經肌肉和神經退行性疾病中的作用。生物資源。2014; 2014:1-10。https://doi.org/10.1155/2014/474296.
Paoli A, Bianco A, Damiani E, Bosco G.生酮飲食在神經肌肉和神經退行性疾病中的作用。生物醫學研究國際,2014;https://doi.org/10.1155/2014/474296.
確認
我們要感謝該家庭參與這項研究並同意發表他們的數據。
資金
沒有資金申報。
作者信息
從屬關係
貢獻
LS、DP:稿件起草;LS、DP、VV、CC、CC、CDV、AM:患者臨床評價及隨訪;CC, CDV, AM:監督項目並對結果的解釋做出了貢獻。所有作者都閱讀並批準了最終的手稿。
相應的作者
道德聲明
倫理批準並同意參與
不適用於本研究;研究的類型不需要當地倫理委員會的批準。從患者父母處獲得適當的書麵知情同意。
所有方法均按照《世界醫學協會道德守則》(《赫爾辛基宣言》)進行。
發表同意書
發表其臨床細節和/或臨床圖像需獲得患者父母的書麵知情同意。
相互競爭的利益
作者宣稱他們之間沒有利益衝突。
額外的信息
出版商的注意
beplay外围下载施普林格自然對出版的地圖和機構從屬關係中的管轄權主張保持中立。
權利和權限
開放獲取本文遵循知識共享署名4.0國際許可協議,允許以任何媒介或格式使用、分享、改編、分發和複製,隻要您對原作者和來源給予適當的署名,提供知識共享許可協議的鏈接,並注明是否有更改。本文中的圖像或其他第三方材料包含在文章的創作共用許可協議中,除非在材料的信用額度中另有說明。如果材料未包含在文章的創作共用許可協議中,並且您的預期使用不被法定法規所允許或超出了允許的使用範圍,您將需要直接獲得版權所有者的許可。如欲查看本牌照的副本,請瀏覽http://creativecommons.org/licenses/by/4.0/.創作共用公共領域奉獻棄權書(http://creativecommons.org/publicdomain/zero/1.0/)適用於本條所提供的資料,除非在資料的信用額度中另有說明。
關於本文
引用本文
聖托羅,L., Pjetraj, D., Velmishi, V.。et al。一個新的表型醛縮酶缺乏症的14歲男孩癲癇和橫紋肌溶解病例報告。兒科J醫院48歲的39(2022)。https://doi.org/10.1186/s13052-022-01228-3
收到了:
接受:
發表:
DOI:https://doi.org/10.1186/s13052-022-01228-3
關鍵字
- 糖原貯積病第十二型
- 醛縮酶A缺乏
- ALDOA不足
- 24 GSD xii
- 生酮飲食