摘要
腦橋小腦發育不全(PCH)是腦橋和小腦的一種異質性神經退行性/神經發育障礙,在產前發病。我們的研究旨在呈現基因診斷的PCH患者的不同臨床和影像學表現。
方法:2018年9月至2021年3月,六名患者參加了這項研究。所有臨床放射學和遺傳學調查都是在庫庫洛瓦大學醫學院進行的。
結果:5名兒童被基因診斷為PCH類型之一(類型10,7,11)。的純合突變CLP1PCH類型10中,TOE1PCH類型7,和TBC1D2PCH 11型中分別檢出3個。PCH 11型患者和PCH 7型女性患者能行走和說話。PCH 7型男性患者性發育障礙。
結論:根據我們的研究,PCH是一種罕見的神經退行性疾病,盡管有些類型是靜態的,如PCH11男性性別和PCH7女性性別。某些臨床特征是特定類型所特有的。PCH7表達性發育障礙,以46xy最為明顯。一些種族群體可以表現出不同的亞型。PCH10在土耳其人群中可見。放射影像學有利於預先診斷;所有患者均有不同程度的腦橋和小腦發育不全。基因檢測如全外顯子組測序-下一代測序在確定明確診斷和確定PCH類型/亞型方麵是必不可少的。
背景
腦橋小腦發育不全(PCH)是一組腦橋、小腦和幕上區域的神經退行性疾病,可能存在異質性差異。然而,也有少數情況下腦橋可以幸免[1].嚴重的小頭畸形,整體發育遲緩,放射學表現如腦橋和小腦發育不全是這種疾病的特征。運動和認知障礙見於各種類型[2].PCH大多在產前發病,表現形式從致命的新生兒亞型到可存活到青春期的較溫和形式不等[3.].PCH的神經學表現與皮層和基底神經節功能障礙有關。與預期相反,小腦症狀並不是任何PCH類型的臨床症狀[3.,4,5].與PCH相關的基因在RNA代謝、蛋白質翻譯中發揮作用,有時也在線粒體呼吸鏈調節中發揮作用[6].在提出PCH分類時,根據相關基因缺陷進行分類。1993年,PCH的第一個分類包括兩個亞型,PCH1和PCH2。自PCH的第一個原始描述,表型已深刻拓寬。許多不同的亞型被添加到PCH的分類中,這些分類最初是基於不同的臨床、放射學或生化特征(如視神經萎縮和腦脊液乳酸升高),後來發現了相關的基因缺陷。至少21個與pch相關的基因被列在OMİM的數據庫中。目前,PCH有15種類型。
PCH1的特征是PCH,此外還有與脊髓性肌萎縮相同的球和脊髓運動神經退行性變。早期的報道將PCH1描述為一種新生兒致命疾病,伴有羊水過多、先天性攣縮、呼吸衰竭和嚴重的肌肉張力過低。後來的研究描述了腹側腦橋的保留和存活到青春期,從而拓寬了PCH1的臨床和神經放射學範圍。目前,有4個基因與PCH1相關(PCH1A-D)。
PCH2A可能是所有PCH亞型中最普遍和最具特征的。PCH2A是由基因的純合突變引起的TSEN54基因。臨床上,PCH2A的特點是新生兒全身性陣攣和吸吮和吞咽不協調。幼兒和幼兒患有痙攣、肌張力障礙/舞蹈病和癲癇,並表現出缺乏自主運動發育。在PCH2A中,睡眠障礙、複發性感染、呼吸暫停和溫度調節問題在大多數患者中均有報道。小頭畸形通常在新生兒期不存在,是進行性的,由幕上萎縮引起。大腦MRI顯示小腦呈“蜻蜓”形,由嚴重影響的半球和蚓部相對保留引起,這是該類型的典型特征。這一組有許多亞型,這些亞型被分為PCH2A、PCH2B、PCH2C、PCH2D和PCH2F。
PCH3的特征為橋小腦萎縮、胼胝體薄、進行性小頭畸形、癲癇發作、身材矮小、麵部畸形,部分患者視神經萎縮。PCH2中典型的錐體外係運動障礙不存在。基因突變PCLO基因是導致這種疾病的原因。
臨床上,PCH4表現為PCH2的嚴重形式,在產前出現症狀,包括羊水過多和先天性攣縮,新生兒長時間陣攣,高張力,原發性低通氣,需要長時間機械通氣。存活超過新生兒期的是罕見的。突變TSEN54是指責。
PCH6表型包括嚴重的早發型癲癇,包括腦橋和小腦在內的進步性全局性萎縮,乳酸性酸中毒和/或線粒體呼吸鏈缺陷。PCH6是由核編碼的線粒體精氨酸trna合成酶(RARS2).
PCH7的特點是罕見的PCH合並性發育障礙。患者表現為嚴重的發育遲緩,嚴重的軀幹低張力,伴高張力肢體和活躍的深層肌腱反射,以及癲癇。性發育障礙。突變TOE1是指責。
PCH8型小頭畸形、嚴重發育遲緩(盡管一些患者能夠獨立行走)、異常姿勢和/或舞蹈動作是該類型的主要特征。一些患者有(先天性)攣縮和癲癇。PCH8可能被認為是PCH的一種“非退行性”形式,是由PCH的突變引起的CHMP1A基因。
PCH9的特征是進行性小頭畸形、嚴重的神經發育遲緩和皮質視覺障礙。據報道,少數患者伴有牙齒異常的麵部畸形。軸突神經病變在老年患者中有報道,可能是由PCH9突變引起的年齡依賴性PCH9AMPD2基因。放射學上有八字形腦幹。據報道,一些土耳其血統的家庭攜帶PCH10。突變CLP1已被確定為致病基因缺陷。
PCH11家族有報道。中截斷或剪接位點突變的患者為純合子TBC1D23基因。它被認為是PCH的非退行性形式,自閉症特征,注意缺陷多動,獨立行走,共濟失調,發育遲緩是主要特征。PCH12是由純合或複合雜合突變引起的COASY g東北偏東。PCH13是由純合或複合雜合突變引起的VPS51基因。PCH14是由純合或複合雜合突變引起的PPIL1基因。PCH15是由基因純合突變引起的CDC40基因和是一種嚴重的常染色體隱性神經發育障礙,其特征是先天性進行性小頭畸形和精神運動發育不良或缺失,從出生起就明顯嚴重受損的智力發育。其他特征包括痙攣性四肢癱瘓、早發性癲癇、慢性貧血和血小板減少[5].
在PCH、睡眠呼吸暫停、進食問題、癲癇、運動障礙、橫紋肌溶解症和血清肌酐激酶強烈升高,特別是在感染期間,可以看到許多問題[2].對於任何類型的PCH都沒有明確的治療方法,對所有類型和亞型的管理都是支持的[7,8,9,10,11].PCH9被認為是一種潛在的可治療的疾病,因為嘌呤核苷酸前體(AICAr)的管理可以在細胞水平上挽救表型。需要後續實驗[5].
材料與方法
2018年9月至2021年9月期間,在Çukurova大學兒科神經病學診所接受治療的患者,在兩個以上的發育領域,小頭症(枕額圍)的裏程碑延遲Z評分> -3)和MRI上的小腦體積損失和腦橋發育不全進行回顧性評估,其中6例基因診斷為PCH的患者被納入本研究。從所有兒童的父母處獲得書麵知情同意。所有有TORCH感染史、嚴重早產史、圍產期窒息繼發新生兒腦病、腦膜炎、顱內出血史、代謝性疾病史的患者均被排除在本研究之外。在神經影像學上有相關皮質發育畸形的兒童也被排除在研究之外。相關問題,如癲癇,視神經萎縮,多發性神經病,和異常的性發育進行了調查和記錄。所有的放射學和遺傳學分析全外顯子組測序-下一代測序(Illumina, California, USA)在Çukurova大學進行。平均隨訪時間至少為三年。
統計分析
所有分析均使用IBM SPSS Statistics Version 2010統計軟件包進行。分類變量以數字表示,而連續變量則總結為平均值和標準差,中位數和最小最大值是合適的。IBM SPSS統計Windows。20.0版。阿蒙克。紐約:IBM公司。
結果
該研究納入了6例病例;5名兒童被基因診斷為PCH類型之一(類型10,7,11)。該突變由基於單基因的全外顯子組測序檢測。中純合突變CLP1c.419G > A(p.R140H), PCH type 10,TOE1PCH type 7中的c.572A > G(p.N191S),以及TBC1D23 (PCH 11型中分別檢測到c.1263 + 1G > A)。在親本中尋找變異突變基因。親本為變異突變基因的攜帶者。
患者1、2、3、4的基因突變為已知變異,在文獻中有報道,臨床特征幾乎相同,而患者5的純合子基因突變(PCH11)TBC1D23基因(NM_001199198)變異:(c.1263 + 1G > A)是一種新的變異,在人類基因突變數據庫HGMD中未見報道。
遺傳模式為常染色體隱性遺傳。芯片參數:(神經網絡對遺傳變異的有害注釋)DANN:0.995,小等位基因頻率MAF:以前未檢測到的變異:該變異是通過整個外顯子組序列識別的,患者的父母都是攜帶者。根據美國醫學遺傳學和基因組學學會(ACMG),該變異的臨床意義被評估為致病變異。
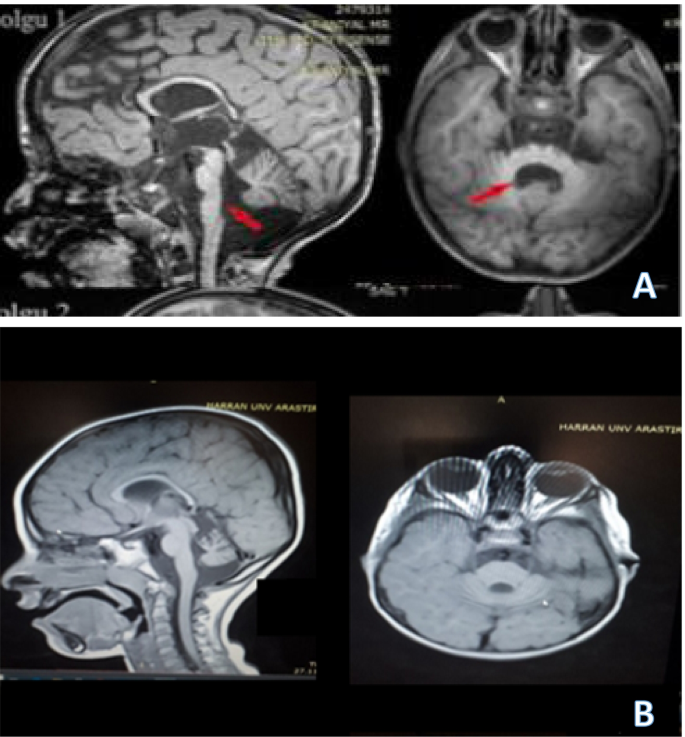
經基因診斷為PCH類型之一患者的平均年齡為7.3±3.13歲,兒童神經內科門診就診時的平均年齡為5.05±3.16歲,診斷時的平均年齡為5.95±2.96歲。其中3例為男性,2例為女性。人口統計資料、共發病、放射學和遺傳學結果見表1.我們的兩例PCH(11,7型)診斷患者的影像學表現如圖所示。1.
除了這些(遺傳診斷並歸類為一種類型的PCH)患者外,我們的門診還申請了一名6歲的男性患者,其生長發育遲緩、運動和認知發育遲緩。他四歲開始小步走路,能說幾句話,有咀嚼和吞咽障礙。體格檢查發現麵部畸形。他的社交能力很差,上的是主流公立學校,但他的表現並不好,並得到了特殊教育支持。代謝測試正常腦MRI顯示腦橋和蚓小腦發育不良,腦室側向增大,胼胝體變薄(圖2)。2).基因測試全外顯子組測序- ngs和複合雜合突變BRF1基因鑒定。文獻中描述了一些病例,這種基因突變與小腦麵碘綜合征有關。我們發現患者目前的表現與該綜合征相符。
討論
PCH是一個總稱,包括一組異質的,罕見的,毀滅性的神經退行性疾病。基因檢測的新發展導致了對PCH新基因和表型的描述。到目前為止,有15種PCH類型和21種與PCH相關的基因被處方[1,12,13].
更新後的分類強調了PCH的兩個重要方麵。雖然這種疾病是退行性的,但PCH8和PCH11都是非退行性的[1,14,15,16].我們的結果部分與其他研究一致,因為患者4(女性-PCH類型7)和患者5(男性-PCH類型11)與其他患者相比可以走路和說話。研究表明,除PCH2D、PCH2E和PCH10在出生後發病外,所有類型均為產前發病。在我們的研究中,患者1、2、4、5出生時頭圍正常。這些結果與其他研究的結果部分吻合。與此同時,Laugwitz等人研究了PCH 11型。他確定了與19個不同基因的致病性變異相關的18種不同的PCH臨床亞型,預測了蛋白質功能的喪失。在這項研究中,腦形態測量顯示腦橋、腦幹和幕上體積損失的模式與PCH2患者相似,但不太明顯。有趣的是,1歲和15歲時的大腦MRI結果清楚地顯示了小腦,特別是半球的進行性萎縮。在文獻報道的四例病例中,可以在顯示的核磁共振成像上評估小腦半球,它們也顯示萎縮葉。 While pontine hypoplasia and pronounced microcephaly are in line with previous reports on PCH11, the observations of this study for postnatal atrophy of the cerebellum argues for a different pathomechanism than in the other forms of PCH. It supports the hypothesis that TBC1D23 deficiency predominantly interferes with postnatal rather than with prenatal cerebellar development [17].在我們的研究中,PCH型11-。
患者5僅有1次MRI,無法比較是否存在進行性小腦萎縮,但我們的患者在學習成績不理想的情況下仍能行走、說話、上學,因此我們認為遺傳缺陷決定了所有類型小腦病理發生的時間,但這方麵還需要進行大量的研究。更新的分類還強調PCH 2型是這種常染色體隱性疾病的最常見形式;盡管如此,我們的患者沒有經曆過這種情況[1,2].
在大多數情況下,這種疾病在生命早期都是致命的。壽命從圍產期死亡到約20-25歲不等。隻有少數人——通常是PCH 2型患者——能活到20歲和30歲[1,4].在我們的PCH研究中,10型男性5歲時因反複呼吸道感染死亡。相比之下,其餘的患者仍然活著,隻是出現了運動障礙和癲癇等問題。臨床應用的患者平均年齡為4.0±2.45歲,診斷平均年齡為5.0±2歲,年齡偏高。這可能是由於最近基因檢測成本的降低,以及最近大規模並行或下一代DNA測序的增加。
PCH,睡眠呼吸暫停,進食問題和癲癇會出現很多問題。患者1、3、5有癲癇發作並使用抗癲癇藥物。在我們的研究中,PCH在女性中的表達似乎比男性更溫和。PCH類型10的女性患者可以用手支撐坐著,沒有癲癇發作,而PCH類型10的男性患者不能坐著,被診斷為癲癇並使用抗癲癇藥物。患有PCH 7型的女性在性發育方麵沒有任何異常,也沒有被診斷為癲癇。相比之下,PCH 7型男性患者有性發育障礙(睾丸缺失和小陰莖被注意到),他被診斷為癲癇。種族也可能在這種疾病的表達變異中發揮重要作用。所以不同人群的臨床表現可能不同。因此需要進行大量的研究[1,2].
PCH並不總是意味著它背後有遺傳背景。也有非遺傳獲得性原因,如先天性巨細胞病毒感染、出血、缺血、暴露於致畸藥物如苯妥英和丙戊酸,以及極度早產(< 32周)。其他遺傳性疾病如先天性糖基化障礙(1a型),dandy walker綜合征,α-糖基化不良相關營養不良(walker Warburg,肌肉眼腦疾病,福山先天性肌肉營養不良),無腦伴小腦發育不良,桶基因缺陷、RELN和vldlr突變、x連鎖hoyeraal-Hreidrasson綜合征、兒童發病的脊髓小腦性共濟失調可能與PCH相似,必須進行檢查,特別是在未解決的病例中(沒有遺傳診斷,也不屬於PCH類型之一的病例)[18,19,20.,21,22,23,24,25,26].但人們無法理解為什麼有些遺傳學,比如BRF1基因,不被認為和分類為PCH基因之一,因為PCH 3型除了橋小腦發育不全外,它們表現出一些麵部畸形和牙齒異常,其他類型的PCH如7型可以表現出其他問題,如男性性發育障礙。在未來,我們想知道其他基因,特別是BRF1,將包括在其中一個類型的PCH。
Namavar發表了169例PCH患者的共享臨床資料等。嚴重的小頭畸形,癲癇,錐體/錐體外係受累,精神運動發育不良。我們患者的常見臨床特征包括小頭畸形、認知能力差、心理發育遲緩、所有患者的錐體和錐體外係運動,以及部分患者的癲癇。我們研究組的所有孩子都是足月出生的,不像Namavar等人.研究.24%的PCH患兒出現早產。我們的結果與Namavar等人部分吻合.研究[3.]但與wafik等人在土耳其人群中發現兩例PCH10的結果相匹配。這兩例患者的主要主訴為嚴重精神運動遲緩、進行性小頭畸形和便秘[27].然而,由於他們的大腦異常和臨床特征的變異性,提示家族內表型變異。同時,我們的患者在出生後沒有出現胎兒窘迫。我們的兩例PCH 10型患者出現神經病變,這與其他研究一致,表明神經病變主要見於PCH 9和10型,患者1、3和5例出現癲癇發作。
種族背景對於確定PCH的某些亞型至關重要,因為在特定的種族中可以看到一些形式。PCH10僅適用於土耳其血統的兒童,而PCH2E適用於摩洛哥猶太血統的兒童。我們的研究與這些結果一致,因為我們的2名患者被診斷為PCH 10型。PCH的每一種類型/亞型都具有特征性特征,如性發育障礙在46xy中最為明顯,而在PCH7中隻能看到。我們的研究與這些結果是一致的,因為患有PCH 7型的男性患者有性發育障礙,而女性患者沒有這樣的問題[1,2].
放射成像有助於明確PCH的類型/亞型,其中腦橋、小腦和幕上腦區可能受到影響。在具有相同突變的患者中觀察到類似的放射學結果,但與臨床嚴重程度的相關性未見報道。第八種模式出現在PCH 9型患者中,蜻蜓出現在PCH 2型患者中。在我們的研究中,MRI的主要特征是不同程度的小腦發育不全和腦橋受累;這與其他研究的結果一致。作為NGS的基因檢測通常在整個過程中都有幫助,但在40%的PCH病例中沒有發現致病基因。[28,29,30.].
任何PCH都沒有特定的治療方法;需要采取支持性措施,如在喂養問題時給予PEG喂養,以及對睡眠呼吸暫停進行睡眠監測。據報道,抗癲癇藥物如苯巴比妥和托吡酯在治療PCH的癲癇發作方麵非常有效,特別是在PCH2A [1,2].我們的研究表明,苯巴比妥在單藥治療和綜合治療中都是有效的。當在汙染治療中加入苯巴比妥後,癲癇發作停止了,但還需要大量的研究。
研究的局限性
PCH是一種散發性疾病;不能包括所有類型被認為是一種限製。缺乏信息性的冠狀視圖;這似乎是第二個限製。
結論
PCH是一種罕見的神經退行性疾病,盡管有些類型是靜態的(PCH7女性,PCH11)。某些臨床特征是特定類型所特有的(PCH7表達性發育障礙,在46xy最為明顯)。一些民族可以表達明確的亞型(PCH 10主要見於土耳其人群),但需要大量的研究。放射成像有助於預先診斷,但基因檢測(通常是全外顯子組測序)對於明確診斷和確定PCH的類型/亞型至關重要。
數據和材料的可用性
在Ass Prof. GGM倉庫。本研究中使用和/或分析的數據集可根據合理要求從通訊作者處獲得。
縮寫
- PCH:
-
Pontocerebellar發育不全
參考文獻
ponto小腦發育不全的臨床、病理和遺傳學研究。神經學。2010;75(16):1459 - 64。
張誌剛,張誌剛,張誌剛。小兒腦橋小腦發育不全的臨床放射學特征。兒科神經雜誌,2020;15(2):94-8。
李誌剛,李誌剛,李誌剛。橋腦小腦發育不全的臨床、神經放射學和遺傳學研究進展。大腦。2011;134:143-56。
吳桂傑,李世傑,李誌強,李誌強,等。大腦外顯子組測序的診斷上限。Hum Mutat, 2020; 41:487-501。
van Dijk T, Baas F, Barth PG, polla - BT.橋小腦發育不全有什麼新進展?基因和亞型的最新進展。歐菲尼特出版社,2018;13:92。
腦橋小腦發育不全:一組胎兒起病的遺傳性神經退行性疾病概述。大腦開發,1993;15:411-22。[PubMed][穀歌學者]。
Rudnık-Schöneborn S, Barth PG, Zerres K.蓬小腦發育不良。Am J Med Genet Part C Semin Med Genet. 2014;166C: 173-83。
Sánchez-Albisua I, Frölich S, Barth PG, Steinlin M, Krägeloh-Mann I.腦橋小腦發育不全2A型的自然病程。中華兒科雜誌,2014;9(1):70。
Rüsch CT, Bölsterli BK, Kottke R, Steinfeld R, Boltshauser E.腦橋小腦發育不良:一種模式識別方法。小腦。2020;19:569 - 82。
Grosso S, Mostadini R, Cioni M, Galluzzi P, Morgese G, Balestri P. ponto小腦發育不全2型:運動障礙對左旋多巴陽性反應的進一步臨床特征和證據。中華神經科學雜誌,2002;26(5):596-600。
李誌強,李誌強,李誌強,等。AMPD2調節GTP合成,在一種可能可治療的神經退行性腦幹疾病中發生突變。細胞。2013;154(3):505 - 17所示。
Kamoshita S, Takei Y, Miyao M, Yanagisawa M, Kobayashi S, Saito K.與嬰兒運動神經元病(Norman’S病)相關的龐托小腦發育不全。兒科病理性。1999;10:133-42。
巴思PG,弗倫森GFJM,尤林斯HBM,奧爾特斯JWE,斯塔姆FC。小頭畸形、運動障礙和橋小腦發育不全的遺傳綜合征:一種早發性全身萎縮。中華神經科學雜誌,1990;37(1):1 - 4。
Rüsch CT, Bölsterli BK.腦橋小腦發育不良:一種模式識別方法。小腦。2020;19(4):569 - 82。
小腦發育不全:鑒別診斷與診斷方法。中華醫學熱病雜誌,2014;26(2):344 - 344。
anikka Y, Yücesoyb G, anikk -İlhanc G.單絨毛膜雙胞雙胞胎Dandy-Walker畸形的胎兒磁共振成像表現。中華兒科神經放射學雜誌。2014;3:91-4。https://doi.org/10.3233/PNR-14093.
Laugwitz L, Buchert R, Groeschel S, Riess A, Grimmel M. ponto小腦發育不全11型:遺傳缺陷是否決定了小腦病理的時間?中華醫學雜誌,2020;26(7):103938。
Barone R, Fiumara A, Jaeken J.先天性糖基化障礙,重點是小腦受累。神經科學。2014;34:357-66。
Clement E, Mercuri E, Godfrey C, Smith J, Robb S, Kinali M,等。腦參與肌營養不良伴糖基化缺陷。中華神經科學雜誌,2008;29(5):349 - 349。
Dobyns WB, Aldinger KA, Ishak GE, Mirza GM, Timms AE, Grout ME,等。編碼GAR結構域高度保守的鋅結合殘基的MACF1突變導致神經元遷移和軸突引導缺陷。胡姆·熱內。2018;103:1009。
李國強,王文傑,等。CASK突變導致x連鎖腦畸形表型,伴有小頭畸形和腦幹和小腦發育不全。中國科學。2008;40(9):1065-7。
洪森,舒嘉YY,黃德華,等。常染色體隱性無腦畸形伴小腦發育不全與人類RELN突變相關。植物學報,2000;26(1):93-6。
Valence S, Garel C, Barth M,等。RELN和VLDLR突變是兩種可區分的臨床-放射表型的基礎。中華臨床醫學雜誌,2016;90(6):545-9。
楊曉明,王曉明,等。進一步描述先天性x -連鎖角化不良症(Hoyeraal-Hreidarsson綜合征)。中華兒科雜誌,2003;32(12):863-7。
遺傳性小腦性共濟失調。神經科學,2014;34(3):280-92。
波雷蒂A,狼NI, Boltshauser E.兒童小腦萎縮的鑒別診斷:最新進展。46 Neuropediatrics。2015;(6):359 - 70。
瓦菲克M,泰勒J,萊斯特T,吉本斯RJ,謝爾斯DJ。土耳其家族全外顯子組測序發現2例10型橋小腦發育不全的新病例。中華醫學雜誌,2018;61(5):273-9。
李文傑,李文傑,李文傑,等。通過模擬酵母中的橋小腦發育不全1b型疾病突變,深入了解RNA外泌體複合物。遺傳學。2017;205(1):221 - 37。
Singh A, Faruq M, Mukerji M, Dwivedi MK, Pruthi S, Kapoor S.嬰兒發病脊髓小腦性共濟失調2 (SCA2):一份臨床報告並回顧既往病例。中華兒科雜誌,2014;29(1):139-44。
Volpe JJ。早產兒小腦:發育迅速,脆弱,臨床上重要。中華兒科雜誌2009;24(9):1085。
確認
不適用。
資金
沒有要申報的。
作者信息
作者及隸屬關係
貢獻
SB計劃研究,SB&GGM協調研究,SB、OH&CH和DO分析文獻,STB分析遺傳結果,OK分析放射圖像,SB是撰寫手稿研究的主要貢獻者。所有作者都閱讀並批準了最終的手稿。
相應的作者
道德聲明
倫理批準並同意參與
該研究由赫爾辛基宣言進行,並由Çukurova大學臨床研究倫理委員會批準(2021:2021/110)。
發表前已獲得監護人的書麵知情同意。
發表同意書
不適用。
相互競爭的利益
作者宣稱他們之間沒有利益衝突。
額外的信息
出版商的注意
beplay外围下载施普林格自然對出版的地圖和機構從屬關係中的管轄權主張保持中立。
權利和權限
開放獲取本文遵循知識共享署名4.0國際許可協議,允許以任何媒介或格式使用、分享、改編、分發和複製,隻要您對原作者和來源給予適當的署名,提供知識共享許可協議的鏈接,並注明是否有更改。本文中的圖像或其他第三方材料包含在文章的創作共用許可協議中,除非在材料的信用額度中另有說明。如果材料未包含在文章的創作共用許可協議中,並且您的預期使用不被法定法規所允許或超出了允許的使用範圍,您將需要直接獲得版權所有者的許可。如欲查看本牌照的副本,請瀏覽http://creativecommons.org/licenses/by/4.0/.創作共用公共領域奉獻棄權書(http://creativecommons.org/publicdomain/zero/1.0/)適用於本條所提供的資料,除非在資料的信用額度中另有說明。
關於本文
引用本文
Bilge, S., Mert, g.g., Hergüner, Ö。et al。橋小腦發育不全症的臨床、放射學和遺傳變異及我們的臨床經驗。兒科J醫院48, 169(2022)。https://doi.org/10.1186/s13052-022-01349-9
收到了:
接受:
發表:
DOI:https://doi.org/10.1186/s13052-022-01349-9
關鍵字
- Pontocerebellar發育不全
- 神經退行性疾病
- 頭小畸型
- 癲癇